放眼国内,目前已有至少7家公司正在开展PD-1单抗药物的临床试验,包括百时美施贵宝nivolumab、默沙东pembrolizumab、阿斯利康MEDI4736、罗氏MPDL3280A、君实JS001、恒瑞SHR-1210、百济神州BGB-A317,另有嘉和生物杰诺单抗注射液,誉衡/药明康德GLS-010、默克avelumab、诺华PDR001陆续申报临床,正在开发PD-1的企业据说不少于60家。
T790M靶向药物的开发竞赛同样如火如荼。除了AZD9191、艾维替尼、迈华替尼之外,贝达药业是第4家在该靶点获得临床批件的公司。根据药物临床试验登记与信息公示平台9月20日公示的信息,贝达药业BPI-15086片的I期临床试验方案已于2016年8月25日获得中国医学科学院伦理委员会审查通过,目前的试验状态是“进行中,尚未招募”,提示BPI-15086片的I期临床研究已经启动。
|
登记号 |
CTR20160704 |
|
适应症 |
晚期非小细胞肺癌 |
|
试验通俗题目 |
BPI-15086 I期临床研究 |
|
试验专业题目 |
BPI-15086在既往EGFR-TKIs治疗后进展的 T790M突变晚期非小细胞肺癌(NSCLC)患者中的I期临床研究 |
|
试验方案编号 |
BTP-26511 |
|
临床申请受理号 |
企业选择不公示 |
|
药物名称 |
BPI-15086片 |
|
药物类型 |
化学药物 |
此外,上海艾力斯艾氟替尼的状态是“制证完毕,待发件”,不日即可获得临床批件,再鼎医药、鸿运华宁、江苏豪森则陆续提交临床申请,处于“在审评”阶段。截至目前,国内已有至少7家公司申报了T790M突变的靶向药物,T790M大战愈演愈烈。
国内T790M肺癌1类新药申报情况
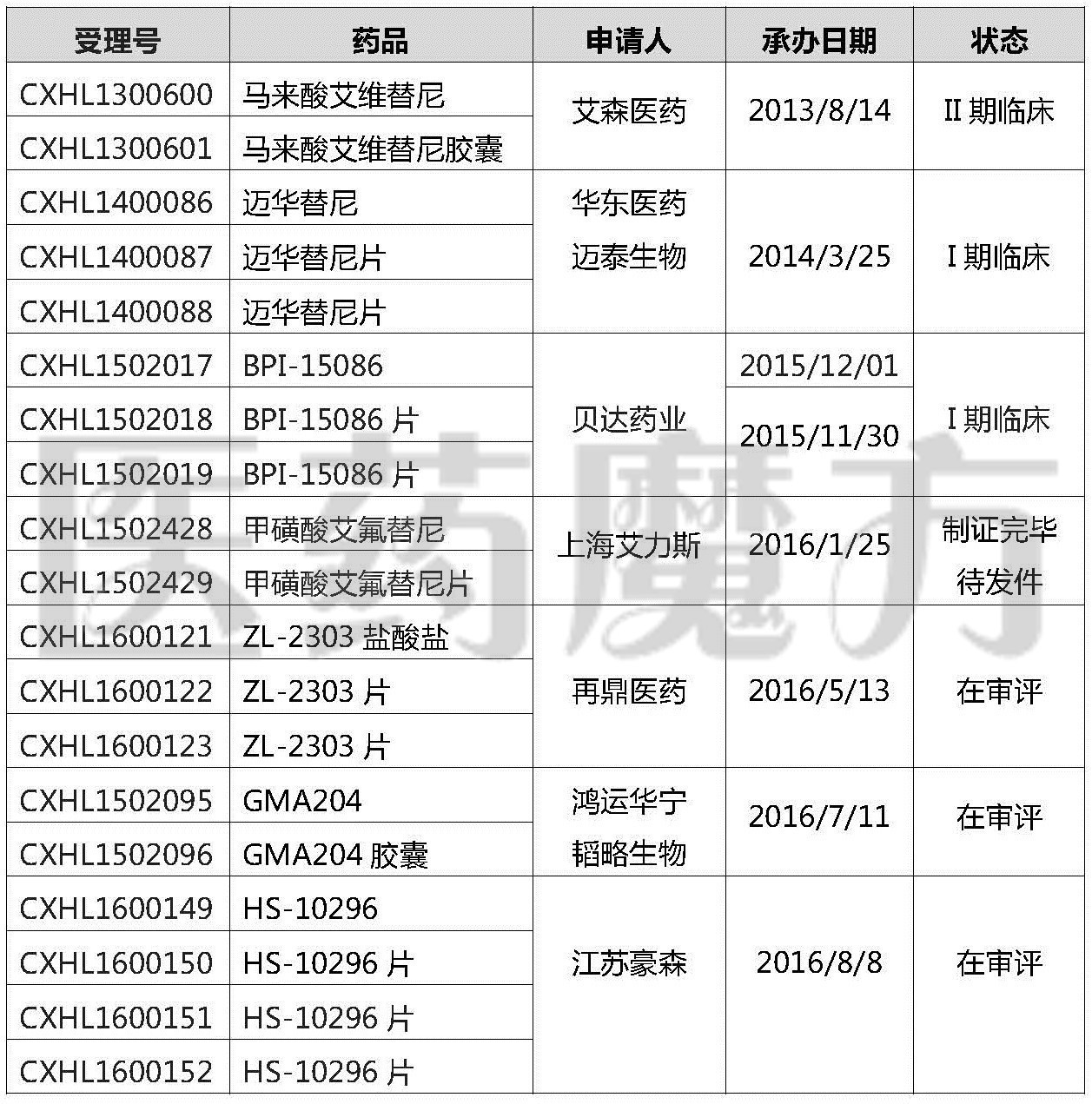
下面对已获批临床的3个国产T790M新药的试验开展情况做一介绍。
1
艾维替尼
艾森医药是国内第一家申报T790M靶向药物的公司。马来酸艾维替尼片的临床申请2013年8月14日获CDE承办,2014年9月获批临床,已完成两项合计入组272人的I期临床研究(CTR20140693,CTR20150009)。
根据艾森生物官方发布的消息,CFDA于今年8月25日下发批件,批准了艾维替尼的II/III期临床试验申请。艾森生物已经启动了艾维替尼II/III期临床试验的多项关键性研究,将在北京、上海、浙江、广东数十家医院入组400例以上的合格患者,计划在2017年上半年完成II/III期临床研究,并尽快递交新药证书和上市申请。
2
迈华替尼
华东医药是国内第2家申报T790M突变药物的企业。迈华替尼片的临床申请2014年3月25获CDE受理,比艾维替尼晚了近半年时间,但是2014年10月即获批临床,只比艾维替尼晚了1个月。
不过在临床试验的推进节奏上,华东医药却又远远落在艾森医药身后。直到今年3月21日才在国家药物临床试验登记与信息公示平台上披露了两项I期安全性、耐受性和药动学研究的信息(CRT20160108,CRT20160122),计划分别入组17~33例实体瘤患者。从时间上看,早在2015年10月16日就完成了第1例患者入组。
华东医药正在晚期非小细胞肺癌患者中开展安全性、耐受性和药动学研究(CRT20160428),计划入组13~25人,第1例患者于2016年4月22日完成入组。
3
BPI-15086片
贝达药业9月20日公示的I期安全性和疗效试验(CTR20160704)采用了非随机、开放标签、单臂设计,计划在国内招募80例晚期NSCLC患者,目前尚未公布第1例患者的入组时间。
该项研究为剂量递增研究,不设对照组,在既往接受过EGFR抑制剂治疗的晚期NSCLC患者中分别考察BPI-15086片12.5,50,100,200,300,400mg(每日1次,连续4周)的安全性和耐受性。
该I期研究分两个阶段,为期18个月。第一阶段剂量递增研究的主要目的是评价BPI-15086的安全性和耐受性,确定最大耐受剂量(MTD)和剂量限制性毒性(DLTs), 获得BPI-15086的药动学和药效学数据。 次要目的是评价BPI-15086的疗效。
第二阶段扩大入组研究的主要目的是进一步评价BPI-15086的安全性和耐受性,确定II期研究推荐剂量(RP2D), 评价BPI-15086的疗效; 次要目的是考察 BPI-15086在患者中的药动学特征、 健康相关生命质量(HRQoL:FACT-L)。







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城