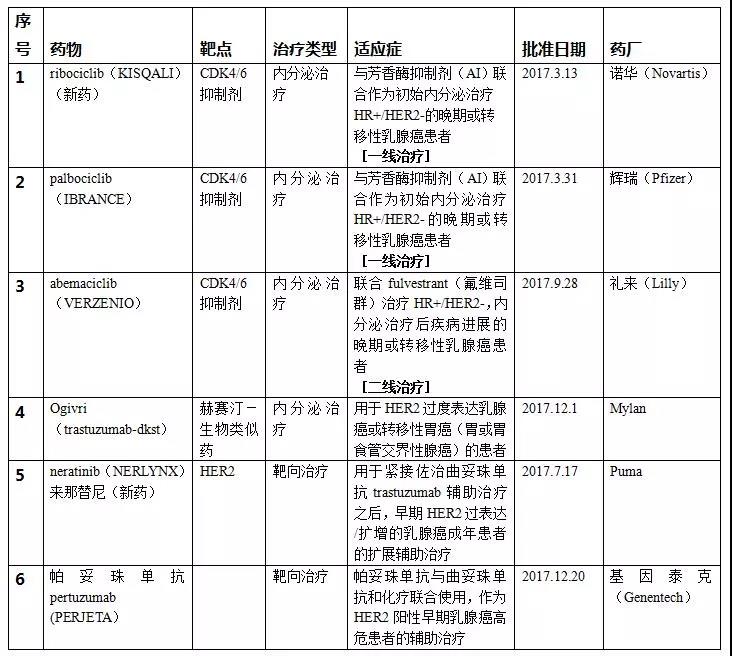
2017年在乳腺癌领域获批了4个新适应症和2个新药。其中靶向药物2个,包括帕妥珠单抗和一个新药来那替尼;内分泌治疗药物4个,包括3个CDK4/6抑制剂:Kisqali、IBRANCE、VERZENIO和1个赫赛汀生物类似药-Ogivri。
2017年美国FDA审批的乳腺癌新适应症和新药
对于激素受体阳性的乳腺癌患者,主要治疗手段是内分泌治疗。但CDK4/6的异常激活会使内分泌治疗发生耐药,如能阻断CDK4/6的激活,可有效控制肿瘤生长。2017年,美国FDA在乳腺癌领域批准了4个CDK4/6抑制剂用内分泌药物,分别如下:
①Ribociclib(瑞博西尼)
17年3月,美国FDA批准了诺华公司新药ribociclib(Kisqali,以前称为LEE011)与芳香酶抑制剂联合作为初始内分泌类治疗方案,用于绝经后激素受体阳性、人类表皮生长因子受体-2阴性(HR+/HER2-)的晚期或转移性乳腺癌女性患者。
这是继辉瑞Ibrance之后第二个CDK4/6抑制剂,作为乳腺癌领域的新药,它的获批是基于一项III期临床研究的数据MONALEESA-2,该研究共纳入了668例绝经后HR+/HER2-晚期乳腺癌初治患者,结果显示,相对于单用芳香酶抑制剂来曲唑治疗,ribociclib与来曲唑联用可将疾病进展或死亡(PFS)风险降低了44%。联合用药组的中位PFS为25.3个月,而来曲唑单药组的中位PFS为16个月。可见ribociclib与来曲唑联合显示了卓越的疗效,目前总生存数据尚未成熟。
②Palbociclib(帕博西尼)
与ribociclib一同获批的一线药物是palbociclib(IBRANCE®, Pfizer),作为全球首个CDK4/6激酶抑制剂在2015年就已通过一项II期研究的无进展生存期(PFS)数据获得了FDA的加速批准,2017年又加入一个新的乳腺癌适应症,与芳香酶抑制剂(来曲唑)联用,作为内分泌基础的一线治疗,用于绝经后HR+/HER2-的晚期乳腺癌患者。
该批准基于一项国际、随机、双盲、安慰剂对照试验PALOMA-2,比较帕博替尼联合来曲唑与来曲唑加安慰剂治疗晚期乳腺癌患者,主要终点是无进展生存期。
试验招募666名绝经后晚期乳腺癌患者,ER+、HER2-、未经激素治疗。随机分组(治疗组2:对照组1),每天125mg帕博替尼或者安慰剂,治疗21天,停止7天;每天曲唑2.5mg,患者在疾病恶化或无法忍受的毒性时停止治疗。病人在治疗初期检查血细胞,每两周查一次。实验组与对照组相比较:无进展生存期(PFS)24.8 vs 14.5个月,生存期延长达将近两倍。
③Abemaciclib

第三个内分泌药是abemaciclib(VERZENIO),2017年9月,获得美国FDA批准上市,abemaciclib获批用于用于激素受体阳性HR+、HER2阴性的晚期或复发乳腺癌治疗。
abemaciclib作为CDK4/6抑制剂,在细胞中,CDK4/6能促进肿瘤的生长,而CDK4/6抑制剂可选择性地抑制细胞周期蛋白依赖性激酶4和6(CDK4/6),恢复细胞周期控制,阻断肿瘤细胞增殖,因此,abemaciclib有望能控制乳腺癌的进展,改善病情。
此项获批是依据一项III期临床试验的结果,入组经内分泌治疗后疾病进展的HR+/HER2-晚期乳腺癌患者669例,随机分到abemaciclib+氟维司群联合组和氟维司群单药组。结果显示,联合组的中位PFS为16.4个月;而单药组患者中位PFS为9.3个月。abemaciclib使患者的PFS有显著改善,因此获批作为经内分泌治疗后进展HR+/HER2-乳腺癌二线治疗。
④Trastuzumab-dkst(曲妥珠单抗生物类似物)

第四个是trastuzumab-dkst(Ogivri),这是第一个由FDA批准的赫赛汀生物类似药,也是美国第二次批准的用于治疗癌症的仿制药。2017年12月,trastuzumab-dkst获得了FDA的优先审批资格,被批准用于治疗赫赛汀标签中的所有适应症,用于HER2过表达的乳腺癌患者,凭借的是一项III期临床研究非常卓越的疗效数据。生物类似药是一种生物制品,除了满足法律规定的其他标准之外,还要有可靠的临床试验数据证明其与已被FDA批准的生物药具有高度相似性,且在安全性,纯度和效力方面没有临床意义上的差异。
对于trastuzumab-dkstogivri预期的副作用研究人员也做出了介绍,其中包括头痛、腹泻、恶心、寒战、发热、感染、充血性心力衰竭、失眠、咳嗽和皮疹。除此之外,trastuzumab-dkst的标签还包括一个黑框警告,那就是增加患心脏病的危险,严重过敏样反应、肺损伤,以及损害发育中的胎儿。
另外两个在获批的是乳腺癌治疗的两个靶向药,分别如下:
①Neratinib(来那替尼)

第一个是新药来那替尼neratinib(NERLYNX), 2017年7月,美国FDA批准了neratinib用于早期HER2阳性乳腺癌的延长辅助治疗,这些成年患者群体先前已接受过含trastuzumab单抗的治疗方案。
这是基于一项多中心、随机、双盲、安慰剂对照试验ExteNET(NCT00878709),在2840例早期HER2阳性、在近两年内完成了trastuzumab治疗的乳腺癌患者随机试验中,研究人员评估了neratinib的安全性和有效性。该研究还测量了试验开始之后癌症复发或死亡发生的时间。经过两年疗程后,经neratinib治疗的患者中94.2%没有发生癌症复发或死亡,而接受安慰剂的患者为91.9%。
neratinib是一种口服的、有效的不可逆的酪氨酸激酶抑制剂,像拉帕替尼和阿伐他汀一样,用于延长辅助治疗早期HER2过表达/扩增乳腺癌的成年患者,通过阻止通过表皮生长因子受体(EGFR),HER1,HER2和HER4信号通路转导,达到抗癌的目的。FDA批准该药后,为早期、HER2阳性、标准曲妥珠辅助治疗后、存在高危风险的乳腺癌患者的强化治疗提供了新的选择。
②Pertuzumab(帕妥珠单抗)
第二个获批的靶向药物是pertuzumab(PERJETA),获批的适应症为与曲妥珠单抗和化疗联合使用,作为HER2阳性的早期高危乳腺癌患者的辅助治疗。
基于一个多中心、随机、双盲、安慰剂对照III期试验APHINITY,评估了作为辅助治疗,与赫赛汀联合化疗相比,pertuzumab联合赫赛汀和化疗的疗效和安全性,共参考了4804例HER2阳性早期乳腺癌患者的治疗情况。
对于HER2阳性可手术乳腺癌患者,在化疗联合赫赛汀基础上加用pertuzumab可显著提高无浸润性疾病生存率。pertuzumab组患者的腹泻发生率高于安慰剂组。
在意向治疗人群(ITT)中,接受Perjeta / 赫赛汀 / 化疗的患者其3年无侵入性疾病生存率(iDFS)为94.1%,优于使用安慰剂 / 赫赛汀 / 化疗的对照组(93.2%),达到了该研究的主要临床目的。
日前,Pertuzumab(帕妥珠单抗)在中国的上市申请获得CDE承办受理,国内患者有望不用出国就能买到。其他药物在美国虽然已经上市,国内上市估计还早得很。若有患者需要,全球肿瘤医生网有资质可以协助国内患者美国购药。
来源:全球肿瘤医生网编辑整理







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城