1、乳腺癌遗传基因BRCA大规模研究即将开启
为了帮助临床医生和患者获得有关遗传变异的更好信息,研究人员开发了一种名为“饱和基因组编辑”的研究方法。这种方法依赖于CRISPR,这是一种切割DNA链以修饰其序列的酶工具。有了它,他们对BRCA1基因进行了数千次微小的修改,甚至是人类尚未见过的变化。然后科学家测量了每个突变的影响,看看哪些突变导致人类细胞在培养皿中生长出来。
研究人员表示,能够在单碱基DNA水平上分解它是非常令人兴奋的。在实验室中研究BRCA1基因的变化,并且它们以令人惊讶的准确性反映了该患者的突变情况。即使我们正在研究培养皿中的细胞,以前只能检查几种不同的突变。现在,当我们对基因组进行更改,将基因编辑成不同的版本,使我们更容易理解DNA的功能。我们基本上将BRCA1基因关键区域的所有可能变化分类为或者表现得像致病突变,研究人员需要大约六个月的时间来测试近4,000个突变。他们正在扩展这项工作,以涵盖未来几年的整个BRCA1基因。
研究人员正在通过Brotman Baty数据库快速发布新的可用变异信息,以帮助患者和临床医生试图找出检测结果可能意味着什么。这个数据库将继续增长,并将成为指导可操作突变解释的中心点,因为它们最初是在女性中观察到的。
科学家计划将饱和基因组编辑方法应用于其他癌症风险基因。这项研究是一个蓝图,用于测试对人类健康有重大影响的重要基因的罕见突变。
2、幽门螺旋杆菌导致胃癌缘起于基因突变菌株
Fred Hutchinson癌症研究中心的研究人员发现幽门螺杆菌的特定菌株与胃癌密切相关。该研究发表在PLOS ONE期刊上,这一发现可为患者制定治疗和筛查策略提供依据。
Fred Hutch团队与郑州大学的研究人员合作,对49名患者的胃内镜检查和粪便样本进行了测试,寻找具有cagA基因变体的幽门螺旋杆菌(又称EPIYA D),他们发现91%的患者患携带EPIYA D株,同时也患有癌症。
我们已经知道幽门螺旋杆菌与胃癌有很强的相关性,但很难确定为什么某些患者,尤其是东北亚地区的患者更容易患胃癌,Nina Salama博士说。虽然这是初步的研究结果,但这些结果可能是确定最高风险群体和改进筛查和治疗计划的第一步。
幽门螺旋杆菌是一种螺旋形细菌,生长在粘液层中,覆盖人体内部并引起溃疡。据信世界上超过50%的人口感染该菌,这是导致胃癌的主要原因。根据世界卫生组织的数据,2015年胃癌是导致癌症死亡的第四大常见原因,约占全球高达20%的癌症。因此,找到致癌原因为开发预防疫苗或更好地识别风险的工具提供线索。
研究小组承认研究中的参与者人数很少,并限制了可以得出的结论。Fred Hutch和郑州大学的研究团队希望进一步开展更大规模的研究。
3、线粒体聚集在一起是原来这样对抗癌症的
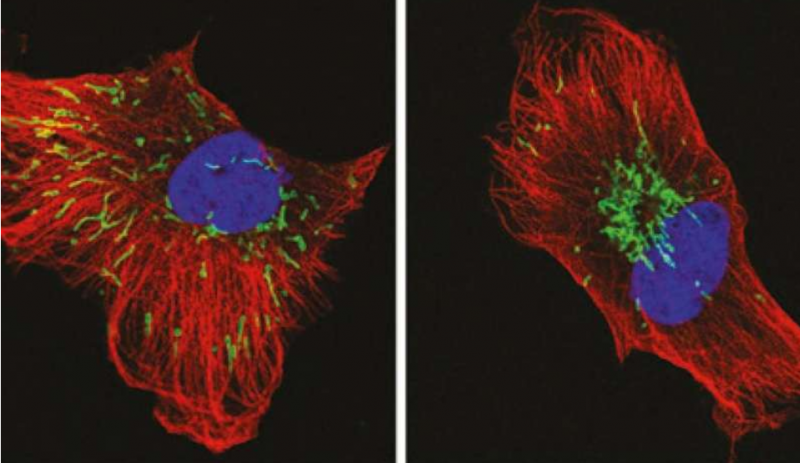
靶向控制细胞的能量来源线粒体运动的途径,可以降低癌症的侵袭性和对放射疗法的抵抗力。北海道大学的一个科学家团队研究了高侵袭性乳腺癌细胞内线粒体运动所涉及的分子。他们确定了一条途径,导致这些产生能量的细胞器分散到细胞周围,增加癌症侵袭力。
当该途径被阻断时,线粒体在细胞中心聚集,过度产生并且泄漏活性氧物质(ROS),这是一种不稳定的含氧分子。已知ROS可增强癌症侵袭性,但过量时,可导致癌细胞死亡。
一些治疗,包括电离辐射,增加癌细胞内ROS的产生,有助于对抗癌症。在Nature Communications发表的这项研究中,研究小组利用荧光化合物标记了浸润性乳腺癌细胞内的各种分子,以跟踪线粒体运动和ROS的产生,然后阻断了涉及侵入性的关键分子。
他们发现,促进整合素在细胞内循环的分子途径,称为Arf6-AMP1-PRKD2,也有利于线粒体的定位,整合素积累导致在细胞膜上形成粘附复合物,最终诱导线粒体向细胞周边运输。破坏该途径导致细胞中心附近的线粒体聚集,降低癌细胞的侵袭性。在实验过程中,研究小组还直接修改了线粒体分布,发现线粒体聚集导致过量ROS的产生,导致癌细胞死亡。
这些研究结果表明,有利于线粒体分散的途径使癌细胞对试图通过增加活性氧物质产生来杀死细胞的治疗更具抵抗力,可能导致新的策略提高活性氧介导的癌症治疗效果,如电离辐射。
4、重大发现:细胞的微环境决定了肝癌的类型
肝癌是全球癌症死亡的第二大原因。原发性肝癌主要有两种形式:大约10%至20%为肝内发生胆管癌(肝内胆管细胞癌; ICC),另外一种是发病率更高的肝细胞癌(HCC)。近年来,具有高侵袭性的ICC患者数量明显增加。由蒂宾根大学医院和德国癌症联盟(DKTK)的Lars Zender教授领导的一个研究小组证明,垂死的肝细胞及其周围环境决定了肿瘤细胞的发展路径。
虽然早期筛查和治疗方法的不断改进降低了其他类型癌症的死亡率,但肝癌患者的死亡率却急剧上升。特别是在西方国家,越来越常见的脂肪肝导致许多患者的肝脏长期受损,这也是肝癌的危险因素。
癌细胞的微环境,特别是在这种环境中发生的特殊形式的细胞死亡,对于各种类型癌症的发展来说是决定性的。科学家们发现癌细胞的前体在其微环境中发生经典性死亡,可发展成肝细胞癌。由于坏死性细胞凋亡而导致癌前细胞在其微环境中死亡,会发展成ICC。在坏死性细胞凋亡中,细胞膜溶解,并且细胞内容物引起癌细胞环境中的炎症,而在经典的程序性细胞死亡中会形成小囊泡,可以被免疫系统消除。
研究结果在小鼠模型和人体组织样品中进行验证。来自人类致癌实验室的癌症研究员Xin Wei Wang提供了重要的人体分析数据,揭示了微环境如何影响癌细胞中的基因调控。这些发现意味着未来的研究会调查细胞环境是否会影响肿瘤的发展类型,进而影响治疗。Lars Zender教授补充说道,“化疗栓塞治疗HCC时观察到,原肝癌的一部分可以变成胆管癌。这可能是癌症不再对原始疗法做出反应的原因。我们正在研究肝癌的治疗抵抗机制,这些研究结果将为未来的新治疗方案提供信息。”
细胞分裂期间的癌细胞。图片来源:美国国立卫生研究院
5、CAR-T细胞免疫疗法治疗胰腺癌有了进展
目前,胰导管腺癌(PDAC)是癌症相关死亡的第四大常见原因,约占胰腺癌发病率的90%,五年生存率不到10%,早期症状很少表现出来,通常在晚期才被确诊。目前治疗胰腺癌晚期的患者只能延长几个月生存期,治疗晚期胰腺癌患者的需求迫在眉睫。
在最近的一项研究中,科学家们将晚期胰腺癌患者的细胞移植到小鼠中,对小鼠进行新的胰腺癌治疗方法的测试。这种新的治疗方法,叫做CAR-T细胞免疫治疗。CAR-T细胞免疫疗法是通过收集病人的T细胞,在实验室中对其进行改造,然后再注回患者体内,这些被改造的T细胞能识别癌细胞。之前的研究表明,CAR-T细胞免疫疗法对治疗白血病和淋巴瘤的病例取得良好的疗效,但它在治疗实体肿瘤方面一直没有取得很好的效果。
本研究结果显示,CAR-T细胞疗法成功地消除了小鼠体内的胰腺癌细胞。研究发现,这种新疗法对难以治疗的晚期胰腺肿瘤模型起到完全缓解的作用。这种疗法有安全有效的改善晚期胰腺癌患者的预后的潜能。这种疗法还显示了对乳腺癌临床模型治疗的潜在疗效。
6、罕见血癌患儿生存率低的现状有望改变
来自St. Jude儿童研究医院和北卡罗来纳州Lineberger综合癌症中心的研究人员报告了关于混合表型急性白血病(MPAL)遗传学的研究结果,这是一种具有急性髓性白血病(AML)和急性淋巴细胞白血病(ALL)特征的罕见血癌,并且患有这两种罕见血癌的儿童患者的长期存活率很低。
由于这种疾病很罕见,研究人员与来自世界各地的合作者合作收集115例病例,全面研究该病的生物学特征。他们分析了DNA和其他遗传特征,以更好地了解疾病的演变过程。他们发现这种疾病的表型亚型具有不同的遗传特征,T / 髓样亚型与早期T细胞前体ALL具有相似性,这一发现可以为 治疗方法提供指导。在B细胞急性淋巴细胞白血病中,B /髓样亚型经常发生ZNF384基因的突变,ZNF384重排可导致一种独特的白血病亚型,这种改变对指导治疗有重大意义。新研究结果为这种罕见血癌的研究奠定了基础,这种血癌在美国约占儿童急性白血病病例的3%。
研究人员还发现,在个别病例中,这些肿瘤的淋巴和骨髓成分含有相同的基因改变,表明这些突变是在血细胞成熟为不同类型之前发生的。这一发现可能有助于解释癌症是如何演变的。研究人员表示,下一步计划是改善表型急性白血病患者的临床结果。
https://medicalxpress.com/news/2018-09-strain-bacteria-chief-factor-stomach.html
https://medicalxpress.com/news/2018-09-mitochondria-cancer-cells.html
https://medicalxpress.com/news/2018-09-cell-environment-liver-tumor.html
https://www.scitecheuropa.eu/pancreatic-cancer-therapy/89155/
https://www.medindia.net/news/study-findings-could-benefit-children-with-rare-blood-cancer-182459-1.htm







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城