2018年12月14日,美国食品和药物管理局(FDA)批准了trastuzumab-pkrb(商品名 Herzuma,Celltrion and Teva联合研发 ),一个HER2/neu受体拮抗剂——赫赛汀®(曲妥珠单抗)的生物仿制药,Herzuma所针对的品牌药为罗氏的超级重磅产品Herceptin(赫赛汀,通用名:trastuzumab,曲妥珠单抗),该药在2017年的全球销售额高达70亿美元。
Herzuma获批适应症包括:
HER2过表达,淋巴结阳性或淋巴结阴性(ER/PR阴性或具有一个高危特征)乳腺癌的辅助乳腺癌
· 联合阿霉素、环磷酰胺和紫杉醇/多西他赛组成联合治疗方案。
· 与多西他赛和卡铂组成联合治疗方案。
转移性乳腺癌
· 联合紫杉醇一线治疗HER2过表达转移性乳腺癌
· 作为单药治疗HER2过表达转移性乳腺癌,这些患者曾接受一种或多种化疗方案失败。
提示:用药前,请先基因检测,了解HER2的表达情况。
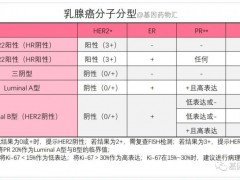
在这些适应症中,应根据FDA批准的曲妥珠单抗产品的辅助诊断而选择患者进行治疗。虽然曲妥珠单抗也被批准用于治疗HER2阳性胃癌,但Herzuma没有获得该适应症的批准。
基于临床数据
该药物的批准基于一个大型临床试验的临床数据,在22个国家的500多名患者中进行,包括药物有效性、安全性、免疫原性、药效学和药代动力学数据。作为HER2阳性早期乳腺癌新辅助治疗的生物仿制药的III期等效试验表明,生物仿制药Herzuma与参考药物-曲妥珠单抗具有相同的效果,试验的两组中,患者达到病理完全反应的比例相似。
接受生物仿制药和参照药的患者不良反应比例也相似,经历了严重的治疗后出现的不良事件(TEAE)(生物仿制组为7%,参考组为8%),最常报告的TEAE为中性粒细胞减少症(4% vs 5 %)。
Celltrion首席执行官Woosung Kee表示:“生物仿制药对肿瘤学领域的重要性越来越大,Herzuma的批准可能会让更多患者获得这种重要的治疗。”“这是我们过去一个月在美国获得的第二份肿瘤生物类似药物批准,进一步强化了我们所有获批产品的目标——为患者和治疗他们的供应商提供更广泛的治疗选择。”
“我们很高兴能够建立Teva在生物仿制药领域的地位,”Teva执行副总裁兼北美商业主管Brendan O'Grady表示。“Herzuma获得批准,更能够提升我们在肿瘤学和仿制药方面的优势。”
Herzuma是继2017年12月Mylan和Biocon批准Ogivri之后的第二个FDA批准的曲妥珠单抗生物仿制药(Ogivri尚未在美国推出)。Herzuma还获得了欧盟(由Mundipharma销售)、日本(由Daiichi Sankyo销售)和澳大利亚的批准。
FDA批准的赫赛汀生物仿制药
2017年12月初,来自迈兰(Mylan)和印度百康(Biocon)的曲妥珠单抗生物仿制药Ogivri(trastuzumab-dkst)获得FDA批准上市,成为美国市场批准的首款曲妥珠单抗生物仿制药,同时也是该市场批准的首款个体化生物仿制药。Ogivri适用于Herceptin全部的适应症,包括HER2阳性乳腺癌。
除此之外,另一个就是刚刚获批的Herzuma,目前,美国FDA仅批准两款
赫赛汀生物仿制药。但是,据统计,全球上市的赫赛汀生物仿制药共有4个,其他两个已经在欧盟及其它国家获批。
欧盟批准的赫赛汀生物仿制药
2017年11月,欧盟医药管理局(EMA)正式批准了Ontruzant,这是获欧盟批准的曲妥珠单抗的第一个生物仿制药。2018年3月初,美国制药巨头默沙东(Merck & Co)宣布在英国推出生物仿制药Ontruzant(trastuzumab,曲妥珠单抗),该药是瑞士制药巨头罗氏品牌药Herceptin(赫赛汀,通用名:trastuzumab,曲妥珠单抗)的生物仿制药,适用于Herceptin的全部适应症,包括:早期乳腺癌、转移性乳腺癌、转移性胃癌。
2018年2月14日,韩国生物技术公司Celltrion宣布,它已获得欧洲委员会(EC)批准其生物仿制药曲妥珠单抗产品Herzuma(CT-P6)。Herzuma是一种抗癌单克隆抗体(mAb)生物仿制药,用于治疗乳腺癌和胃癌。该公司于2014年1月获得了韩国食品药品安全部(MFDS,前韩国食品药品监督管理局)批准的Herzuma ,并于2017年在韩国推出了生物仿制药。
2018年8月,辉瑞宣布旗下的赫赛汀生物仿制药Trazimera获欧盟批准,这是全球第4个获批的赫赛汀生物仿制药,前3个分别为韩国Celltrion公司的Herzuma、三星Bioepis公司的Ontruzant、Mylan和Biocon公司的Ogivri。目前,来自Celltrion、三星和安进的赫赛汀生物仿制药已经在欧盟上市四个月,现在已占据了6%的市场份额。此外,赫赛汀生物仿制药的竞争仍在加剧,特别是在英国和德国等地区。
Celltrion公司
总部位于韩国仁川,是一家领先的生物制药公司,专门从事生物仿制药和创新药物的研究,开发和生产。Celltrion致力于为以前无法获得高级治疗药物的患者提供更实惠的生物仿制药单克隆抗体。Celltrion分别获得了FDA和EC对Inflectra®和Remsima®的批准,这是世界上第一个获得发达国家监管机构批准的mAb生物仿制药。
Teva公司
Teva制药工业有限公司是仿制药的全球领导者,在特定领域提供创新治疗,包括中枢神经系统、疼痛和呼吸系统,提供高质量的通用产品和药品,以满足未被满足的患者需求。在仿制药,专业,OTC和API方面拥有稳固的地位,是一个百年传统企业,具有完全集成的研发功能,强大的运营基础以及全球基础设施和规模,努力对社会和环境负责。总部位于以色列,在全球设有生产和研究机构,共有45,000名专业人员,致力于改善数百万患者的生活。
https://www.drugs.com/newdrugs/fda-approves-herzuma-trastuzumab-pkrb-biosimilar-herceptin-4884.html