肝癌免疫疗法,肝癌的免疫治疗,肝癌免疫治疗药物有哪些
中国可谓名副其实的肝癌大国,据世卫组织2018年发布的全球癌症统计报告中国每年新发的肝癌达到39.3万例,死亡病例则有36.9万例,这两个数字不仅让肝癌在中国位居恶性肿瘤发病率第四、死亡数第二,更是占到了全球肝癌的50%以上。
中国的肝癌发病率如此之高,主要与病毒性肝炎有关,其中乙肝相关的肝癌,占到全部肝癌的65%以上。此外致癌物黄曲霉素、饮酒导致的酒精肝、肥胖相关的脂肪肝这些,也都是肝癌发病的危险因素。
然而发病率高,还只是肝癌在中国棘手的原因之一,另一大原因就是患者的生存率低。肝癌发病隐匿,85%患者确诊时已失去手术机会。目前,中国肝癌患者的5年生存率只有约10%,在所有常见癌症中排名倒数第二,仅高于胰腺癌,患者生存期也在肝癌整体高发的东亚垫底。
目前,肝癌的主要治疗手段包括手术治疗、介入治疗和系统治疗,其中系统治疗包括化疗、靶向治疗和以PD-1/PD-L1抑制剂为代表的肿瘤免疫治疗。
过去10多年,索拉非尼都是晚期肝癌的一线标准治疗方案。一旦耐药,可供选择的治疗方案有限。肝癌免疫治疗的出现,迈出了对中国患者意义非凡的一步。
突破瓶颈,免疫检查点抑制剂为肝癌患者带来新希望
免疫检查点抑制剂是最成功的免疫疗法之一,在各癌种的治疗上都表现出卓越的疗效。以往不能手术的肝癌患者多以局部化疗和靶向药治疗为主,免疫检查点抑制剂的出现打破了肝癌临床治疗格局,给肝癌患者带来新的生存希望。
1.免疫联合疗法
1.1生存率大幅提高,T+A成功获批肝癌一线治疗,且更适合中国患者
2020年5月30日美国FDA批准PD-L1抑制剂Tecentriq(atezolizumab,阿替利珠单抗)与Avastin(bevacizumab,贝伐单抗)联用,一线治疗无法切除或转移性肝细胞癌(HCC)患者。这是目前唯一获得FDA批准一线治疗无法切除或转移性肝细胞癌的癌症免疫治疗方案。也是十几年以来,首个改善患者总生存期和无进展生存期的治疗方案。
此次获批基于临床III期试验IMbrave150的成功。数据显示,与目前一线治疗的标准方案索拉非尼单药相比,T+A方案使患者死亡风险相对下降了42%。
在疾病进展风险方面,T+A治疗的数据也差不多,将患者的中位无进展生存期(PFS)从4.3个月提升到了6.8个月。而且值得注意的是,T+A方案显著延缓了患者报告生活质量因病恶化(TTD)的时间。
另外,T+A免疫联合治疗组患者,12个月生存率达到67.2%。这一数据,也成功突破了不可切除肝癌一线治疗生存期的瓶颈。
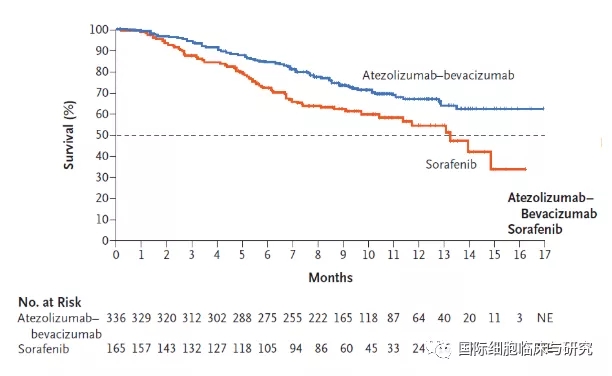
预计缓解时间超过6个月的患者在“T+A”组占87.6%,远高于索拉非尼组的59.1%,体现了免疫治疗“一旦缓解,就有望长效获益”的特点。随着后续更长期的随访数据成熟,相信免疫联合治疗在晚期肝癌上的持续获益也会更明确。
IMbrave150试验中国亚组的数据,也提示T+A可能会更适合中国患者的治疗,这项分析中包括了194名中国患者。数据显示,在患者整体有着更高的乙肝感染率、大血管侵犯/肝外转移、甲胎蛋白≥400ng/ml等多种预后不良因素的状态下,中国亚组患者OS的HR值为0.44,患者6个月生存率达到86.6%,意味着疗效比试验整体人群更出色!
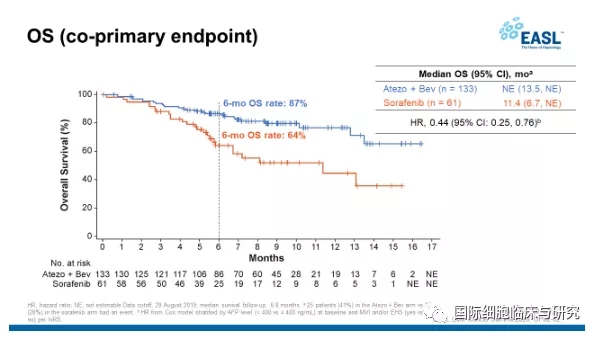
IMbrave150试验显示,免疫联合治疗方案能够显著降低死亡风险56%,患者的6个月生存率为86.6%,总生存期(OS)改善较之前公布的全球数据更显著。意味着这种联合疗法在中国肝癌患者中同样有效,可能更佳。
基于该试验对中国患者的惊艳数据,相信该疗法在中国获批上市之日不远,我们期待该疗法为国内患者带来惊喜!
1.2生存期明显延长,O+Y获批肝癌二线疗法
CheckMate-040的Ⅰ期和Ⅱ期联合临床试验中,接受Opdivo+Yervoy治疗的患者的效果相当可观,总体缓解率(ORR)和缓解持续时间(DOR)得到了明显的提升。
在入组的49位患者中,有16位患者得肿瘤显著缩小,总缓解率达33%,其中有8%的患者完全缓解(CR),24%的患者部分缓解(PR)。根据盲法独立中心评估(BICR),所有患者疾病缓解率(ORR)为35%。
88%的患者缓解持续时间至少6个月,56%的患者至少12个月,31%的患者至少24个月。所有患者的缓解持续时间(DOR)介于4.6-30.5个月之间。
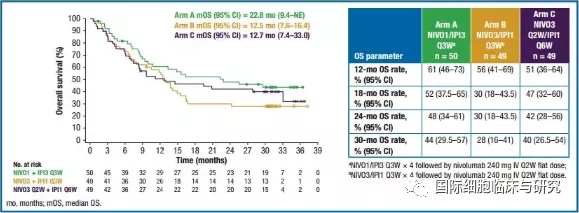
基于以上试验数据,3月11日,美国食品药品监督管理局(FDA)正式批准纳武单抗(Opdivo,欧狄沃,O药)+伊匹单抗(Yervoy,Y药)用于既往接受过索拉非尼治疗的肝细胞癌(HCC)的患者。
1.3疾病控制率93.3%,K+L(可乐组合)获突破性疗法认定
一项开放标签单臂Ib期临床研究KEYNOTE-524/Study 116研究的中期分析数据显示,30例患者接受Keytruda(pembrolizumab,帕博利珠单抗,K药)联合Lenvima(lenvatinib,乐伐替尼)治疗,研究者和独立评估委员会评估的有效率和疾病控制率分别为:客观缓解率(ORR)分别为36.7%和50%,疾病控制率(DCR)分别为96.7%和93.3%。中位无进展生存期(PFS)为9.7个月,6个月生存率和12个月生存率分别为83.3%和59.8%。最常见的不良反应为食欲减低(63%)和高血压(60%),未观察到新的不良事件。
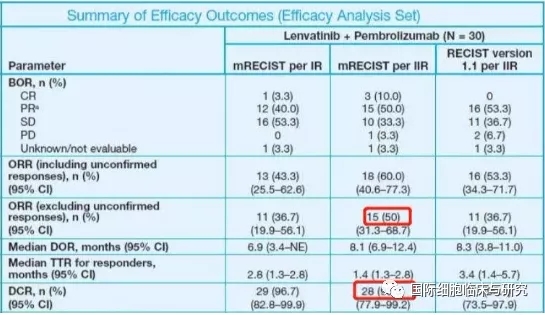
基于以上数据,美国FDA也已经授予Keytruda(pembrolizumab,帕博利珠单抗,K药)联合Lenvima(lenvatinib,乐伐替尼)疗法突破性疗法认定(BTD),用于一线治疗不能局部治疗的晚期不可切除的肝细胞癌(HCC)患者。
1.4不甘落后,D+T组合冲击肝癌一线治疗
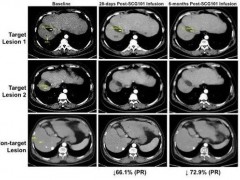
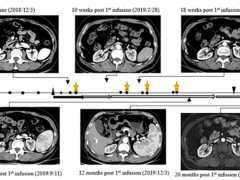
本届美国临床肿瘤学年会(ASCO)口头报告PD-L1单抗Durvaluamb(德瓦鲁单抗,D药)联合CTLA-4单抗tremelimumab(T药)一线治疗晚期肝细胞癌的临床研究。
该试验共纳入332例对索拉非尼不耐受或拒绝接受索拉非尼治疗的患者,分为四组:
T300+D组、T75+D组、单药D组、单药T组,
试验结果(T300+D组VS T75+D组VS单药D组VS单药T组):
中位总生存期(mOS):18.7 (10.8-NR)vs11.3 (8.4-14.6) vs 11.7 (8.5-16.9) vs 17.1个月(10.9-NR);
客观缓解率(ORR):22.7% vs 9.5%vs 9.6% vs 7.2%;
3/4级不良反应:35.1% vs 24.4% vs 17.8% vs 42.0%
结果可看出T300+D方案无论是从mOS还是ORR,都进一步支持了其在晚期肝细胞癌(aHCC)上的显著疗效。正在进行的HIMALAYA III期研究正在评估T300+D和D对索拉非尼一线治疗肝细胞癌(HCC)的疗效(NCT03298451),期待阳性结果!
1.5结果喜人,国药恒瑞双艾(卡瑞利珠单抗+阿帕替尼)成为ASCO亮点
在2018年美国临床肿瘤学会年会(ASCO)上,恒瑞双艾方案(卡瑞利珠单抗+阿帕替尼)在多种实体肿瘤的I期研究中,16例可评估疗效的二线肝细胞癌患者客观缓解率(ORR)达50.0%,中位PFS达7.2个月。该研究是在肝癌免疫领域首批将PD-1抑制剂与抗血管靶向联合的探索性研究之一,成为当年ASCO的亮点,促成该领域更多研究探索的开展。
基于此,卡瑞利珠单抗联合阿帕替尼对比索拉非尼一线治疗晚期肝细胞癌的全球多中心临床研究正在开展。这个研究,也是国内自主研发创新药首个开启全球多中心三期研究,获得各大监管部门的批准(含美国FDA,中国NMPA),某种程度上也证明了业内对恒瑞双艾方案的看好。
同时,卡瑞利珠单抗联合FOLFOX4对比标准疗法(索拉非尼或FOLFOX4)一线治疗晚期肝细胞癌的全国多中心III期临床研究也已开展。
1.6国产PD-1单抗(Penpulimab)联合安罗替尼一线治疗晚期肝细胞癌初见成效,成功入选2020年ASCO大会
Penpulimab是一种国产新型人源化抗PD-1 IgG1单克隆抗体,截至2020年1月14日,共31例患者接受了安罗替尼联合penpulimab的联合治疗,在25例可评估疗效的患者(12周内随访次数≥2)中,客观缓解率(ORR)为24%(6/25),疾病控制率(DCR)为84%(21/25),5例疗效应答者的疗效仍在持续中,缓解持续时间(DOR)为1.4个月至6.9个月左右。
安全性:≥3级治疗相关不良事件(TRAE)发生率为12.9%,其中仅1例患者(3.2%)发生了3级高血压,仅有1例患者(3.2%)因治疗相关的不良事件停止治疗。最常见的不良反应有AST升高(35.5%)、ALT升高(29%)、乏力(22.6%)、血小板减少(19.4%)、血胆红素升高(19.4%)和皮疹(16.1%)。
Penpulimab联合安罗替尼一线治疗不可切除的肝细胞癌患者初步显示出令人鼓舞的疗效和良好的安全性。并且成功入选2020年美国临床肿瘤学会(ASCO)壁报展示。
2. 免疫单药疗法
2.1 O药、K药先后获批肝癌二线治疗,又相继折戟
2017年9月,美国FDA批准了Opdivo(Nivolumab,纳武利尤单抗,O药)用于肝癌二线治疗,使其成为首个获批的肝癌肿瘤免疫治疗药物。获批基于CheckMate-040试验,试验结果显示,未接受过和接受过索拉非尼治疗的患者,客观缓解率(ORR)分别达到20%和19%,中位总生存期(OS)分别为28.6个月和15.6个月(扩展组)。无论既往是否接受过索拉非尼治疗,使用纳武利尤单抗患者均显著获益。安全性方面,未接受和接受过索拉非尼治疗者的3~4级不良事件发生率分别为29%和18%,无预期外的不良事件发生。
2018年11月,美国FDA加速批准K药(Keytruda,帕博利珠单抗)用于肝癌的二线治疗,审批依据为Keynote-224研究。数据显示,针对索拉非尼耐药的肝癌患者,K药作为二线治疗药物,客观缓解率(ORR)高达17%,疾病控制率(DCR)为62%。≥3级治疗相关不良事件发生率为26%。表明帕博利珠单抗二线治疗晚期肝癌有效且可耐受。
但是,但最新的两个大型III期临床试验CheckMate 459和KEYNOTE-240研究结果,均未达到预设的主要终点。
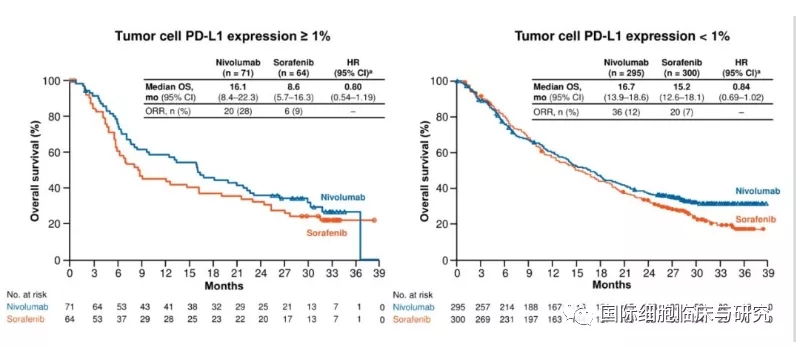
CheckMate 459是一项随机、多中心的临床Ⅲ期研究,主要研究,与索拉非尼相比,纳武利尤单抗治疗的晚期肝癌患者的有效性和安全性。试验纳入743例未接受系统治疗的晚期肝癌患者。结果显示,纳武利尤单抗组和索拉非尼治疗组总生存期(OS)分别为16.4个月和14.7个月,尽管有所延长,但无统计学意义(P=0.0419);纳武利尤单抗组12个月OS发生率为59.7%,索拉非尼组为55.1%。
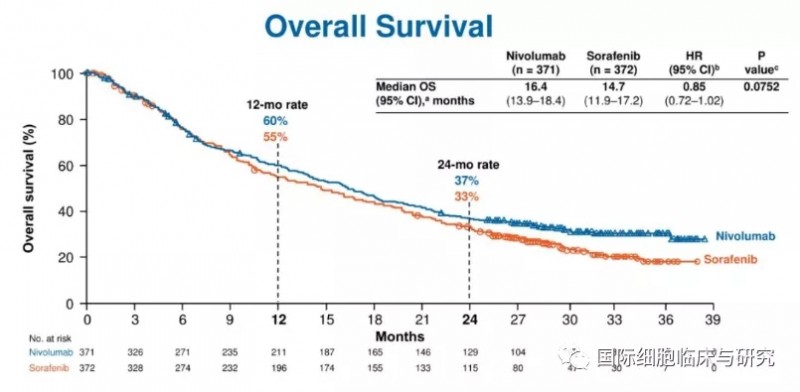
另外,纳武利尤单抗和索拉非尼治疗组中位无进展生存期(PFS)相似,分别为3.7个月和3.8个月,未显示出优越性。
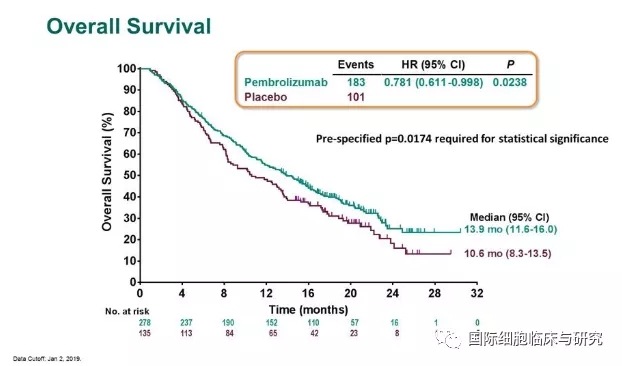
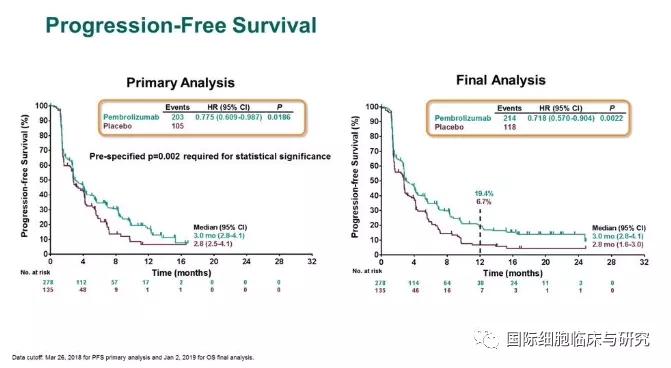
KEYNOTE-240试验共纳入413例患者,帕博利珠单抗和安慰剂组分别为278例和135例。结果显示,相比于安慰剂,帕博利珠单抗延长了3个月的总生存期(OS)(13.9个月vs 10.6个月),无进展生存期(PFS)也有改善,但这一差异未达到既定的显著性水平。
以上试验表明,尽管O药、K药已获批用于肝癌二线治疗,但临床仍需更多的数据来验证其有效性,从而使更多肝癌患者获益。
2.2国产PD-1抑制剂在国内获批,效果不输O药、K药
2020年3月4日,卡瑞利珠单抗(商品名:艾瑞卡)正式获得中国药监局批准,用于晚期二线肝癌的治疗,具体获批适应证为:接受过索拉非尼治疗和/或含奥沙利铂系统化疗的晚期肝细胞癌患者。
卡瑞利珠单抗是中国本土研发的免疫药物,在200多位中国晚期复发难治肝癌患者参加的临床试验中,卡瑞利珠单抗取得了积极的疗效,14.7%的患者肿瘤显著缩小,6个月存活率达到74.4%,所有患者的中位生存期是13.8个月。
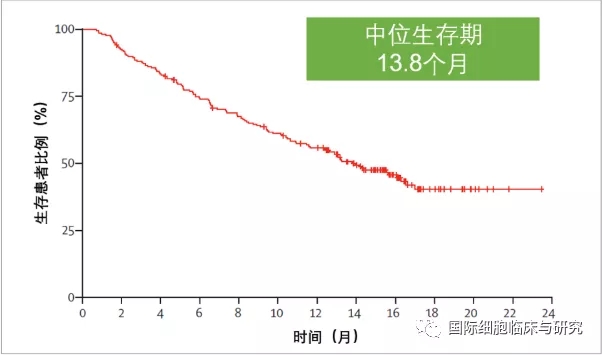
该试验首次证实了以HBV为主的中国晚期肝癌患者可以从免疫治疗获益。特别值得一提的是,在入组人群基线更弱的情况下,卡瑞利珠单抗取得了不输于O药、K药的疗效,为治疗选择寥寥无几的晚期肝癌提供了更多生存的希望。
并且,作为第一个在中国获批的晚期肝癌PD-1抑制剂,卡瑞利珠的获批是一个里程碑事件!
过继性细胞疗法
过继性细胞疗法是指将体内有抗肿瘤活性的细胞分离出来,在体外进行诱导、修饰、培养后再回输给患者,起到抗肿瘤目的的免疫疗法。过继性细胞疗法是肿瘤免疫治疗一个重要的分支,在推进免疫疗法的发展中做出了不可磨灭的贡献,尤其是嵌合抗原受体T细胞(CAR-T)疗法在血液肿瘤治疗中表现惊艳,成为唯一被FDA批准上市的细胞产品。随后,越来越多的过继性细胞疗法向实体瘤发起冲击,希望在实体瘤的治疗上做出突出贡献。
1. 以T细胞为主的细胞疗法
1.1CAR-T疗法率先公布试验数据

近期,《Clinical Cancer Research》线上公布一款靶向磷脂酰肌醇蛋白聚糖3(GPC3)的CAR-T疗法的临床结果,经治疗的患者在6个月、1年和3年时的总生存率分别为50.3%、42.0%、10.5%;13名患者中观察到了2例部分应答,两名患者的目标病变表现出明显的萎缩;其中一名患者疾病未进一步进展,并且生存期达到了44.2个月。
在治疗安全性方面,分别在13例、12例和9例患者中观察到发热,淋巴细胞计数减少和细胞因子释放综合征(CRS);CRS(1/2级)在8例患者中是可逆的,一名患者经历了5级CRS,没有患者出现3/4级神经毒性。
在公开的临床结果中,尤其值得注意的是,在该研究的治疗和随访过程中,研究人员观察到了CAR-GPC3 T细胞在晚期肝细胞患者中扩增和抗肿瘤活性的早期迹象。
这是我国第一项釆用CAR -T细胞治疗实体瘤和肝癌的注册临床试验,也是目前全球公布的首个靶向于GPC3实体瘤的CAR-T细胞治疗临床结果,显示了CAR-T疗法在肝细胞癌中的临床应用潜力。但该研究样本数量少,对于CAR-GPC3-T细胞疗法的有效性及安全性尚需更大样本的临床验证。
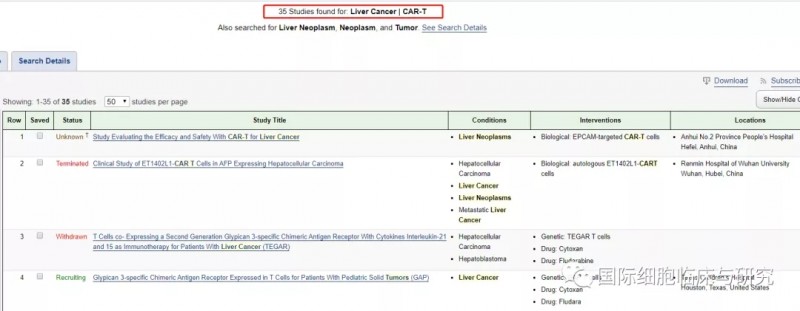
据统计,目前全球基于CAR-T疗法用于肝癌治疗的临床开发项目共计35项,其中超过一半来自中国研究人员,治疗靶点覆盖了GPC3、CD147、CEA等,且大多数的靶点均为GPC3。
1.2TCR-T获批孤儿药资格,临床试验正在进行中
2017年,美国 FDA 已授予新加坡的生物医药公司 Lion TCR 两项用于治疗肝癌的 T 细胞疗法的孤儿药资质(ODD)。Lion TCR 正在开发两个产品用于治疗肝癌,包括短效的 mRNA 转导和长效的 DNA 转导的 HBV 特异性 TCR 重定向 T 细胞。
目前,该公司在研TCR候选产品(LioCyx™)治疗肝移植后复发肝癌的 I / II 期多中心临床研究已经获得新加坡卫生科学管理局(HSA)批准,而且是全球首次药监局批准的mRNA转导TCR受体 T 细胞针对乙型肝炎病毒(HBV)相关肝癌免疫细胞治疗的临床试验。
患者招募从新加坡国立大学医院(NUH)开始。此外,值得注意的是,Lion TCR 同时也邀请新加坡和中国更多医疗中心纳入多中心临床试验,也向包括中国在内的其他国家药监部门申请批准 I / II期临床试验。

1.3DC-CIK联合疗法改善患者预后有潜力
一项研究评估DC-CIK免疫治疗联合TACE、RFA治疗肝细胞癌的临床疗效,并与TACE和RFA序贯治疗进行比较,其研究结果显示:TACE+RFA+CIK组(85例)总有效率为76.5%,而TACE+RFA组(89例)总有效率为79.8%;TACE+RFA+CIK组患者疾病控制率高于TACE+RFA组,但差异无统计学意义(95.3%比88.8%,P=0.113)。TACE+RFA+CIK组患者的总体生存时间和无进展生存时间显著长于TACE+RFA组[(56个月比31个月,P=0.001)和(17个月比10个月,P=0.001)]。
该研究结果显示:DC-CIK细胞免疫治疗可以预防肝细胞癌TACE和RFA术后肿瘤复发和转移,改善患者预后和生命质量,是一项具有应用潜力的肝细胞癌治疗方法。

除此之外,以T细胞为主的CIK、TILs等疗法针对实体瘤的研究也多有尝试,但目前尚未取得实质性突破,仍需进一步研究。
2.自然杀伤细胞(NK)疗法实力赶超CAR-T
2017年底,国内某科研机构在权威医学期刊Molecular Therapy发表了第一篇靶向GPC3的CAR-NK治疗肝细胞癌的研究论文。结果显示,GPC3-CAR-NK细胞株(NK-92/9.28.z)在体内外均能够特异性地靶向并杀伤表达GPC3的肝细胞肝癌,并且不受血清水平可溶性GPC3、实体瘤低氧环境和TGF-β的影响。与目前的CAR-T细胞治疗相比,CAR-GPC3-NK治疗方案节约大量成本。

过继性细胞疗法在肝细胞癌治疗中显示出巨大的潜力,我们期待他能在肝细胞癌治疗中发挥更大的作用。
肿瘤疫苗
肿瘤疫苗也是免疫疗法的一个重要分支,也是免疫治疗领域的研究热点,其原理是通过各种形式将肿瘤抗原信号导入体内,激活机体的免疫反应,利用自身免疫功能杀灭肿瘤细胞,起到抗肿瘤的效果。
目前,针对肝癌的肿瘤疫苗尚无获批产品,大多在临床试验阶段。
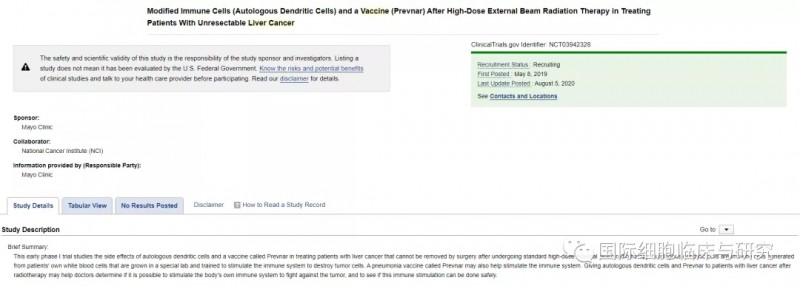
美国国立癌症研究所(NCI)和梅奥诊所合作研究了自体树突状细胞和一种称为Prevnar的疫苗在治疗肝癌患者中的副作用,主要目标为:评估在大剂量保形体外放射治疗(EBRT)治疗的原发性肝癌患者中,通过肿瘤内注射递送的自体树突状细胞(DC)疫苗的安全性和耐受性评估。
目前该临床试验正在进行中,预计于2022年5月完成主要目标。
另外,由中国解放军总医院和力康生命科学控股有限公司合作的基于新抗原的树突状细胞(DC)疫苗与微波消融联合治疗肝细胞癌(HCC)的临床研究也在进行中,研究人员正在研究结合微波消融的个性化基于新抗原的DC疫苗的安全性,可行性以及对该疫苗的T细胞免疫反应。

溶瘤病毒
溶瘤病毒是目前临床研究的热点项目,其具有可选择性破坏肿瘤细胞而不损伤正常细胞的特性,可通过多种机制促进抗肿瘤T细胞应答,包括刺激促炎细胞因子的产生和破坏免疫抑制细胞类型,如肿瘤微环境中的癌相关成纤维细胞;此外,溶瘤病毒感染产生的促炎环境可以将免疫抑制细胞类型(如M2型巨噬细胞)转化为更强的抗肿瘤表型;最后,溶瘤病毒可以通过上调参与抗原的加工和递呈的通路,包括增加肿瘤细胞的主要组织相容性复合体的表达,提高免疫系统对肿瘤细胞的识别。
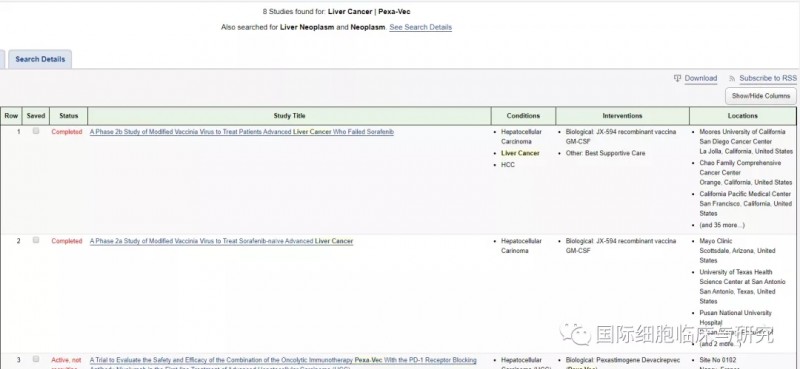
目前,国内外多项针对肝癌的溶瘤病毒临床试验都在进行中,以期能够以溶瘤病毒打破实体瘤免疫抑制的微环境,为肿瘤免疫疗法打开新的治疗局面。
肝癌是恶性程度最高的恶性程度之一,我国肝癌死亡人数占全球50%以上。目前,临床治疗手段有限,患者预后不容乐观。
进入二十一世纪,免疫疗法蓬勃发展,也为肝癌患者迎来新的生存希望。我们期待随着免疫疗法的不断进步,免疫疗法能够突破肝癌患者的临床治疗瓶颈,为改善肝癌患者的预后和生存状况做出贡献。
参考资料:
1. https://mp.weixin.qq.com/s/LO34mzIdgv3g10QUK84ytw
2. https://mp.weixin.qq.com/s/4rUEc7cSAnAERdB41XbVJg
3. https://mp.weixin.qq.com/s/8xfHhyqfWG0OJG7NnHw4qw
4. https://mp.weixin.qq.com/s/hFa_uYXG7erZaExgHlFALQ
5. https://mp.weixin.qq.com/s/oividSWHUtYl7jb-X7eHQQ
6. https://mp.weixin.qq.com/s/KXAT-2tw6jChNlXlhY_3vg
7. https://mp.weixin.qq.com/s/1cTuE15mM1UsTJDx_IotCg
8. https://mp.weixin.qq.com/s/Fh_q7w1Cg9PC5TdLnkl7Kw
9. https://mp.weixin.qq.com/s/i-7aJkarogG6Na6NRKge4w
10. https://m.sohu.com/a/219952728_682259