2020年胃癌临床试验招募汇总
胃癌是我国常见的恶性肿瘤,也继肺癌之后的第二大癌种,发病率和死亡率都高居恶性肿瘤排行榜前列,而且我国胃癌发病和死亡人数分别占全球44%和50%,约80%的中国胃癌患者确诊时已是晚期,即使接受了胃癌根治术,仍有超过一半的患者局部复发或远处转移,而发生转移的胃癌患者5年生存率不足10%。
在治疗方面,胃癌一线治疗仍以手术、放化疗为主,而临床获批靶向药物仅有为数不多的几种,势单力薄,对胃癌患者总生存期的改善差强人意。总之,中国胃癌治疗形势严峻!
新版NCCN(美国国立综合癌症网络)指南认为任何肿瘤患者都可以在临床试验中获得最佳治疗,因此特别鼓励肿瘤患者参加临床试验。
本文汇总胃癌患者临床试验信息,供大家参考。
01、生存期显著延长,新药Zolbetuximab展现良好治疗潜力
Zolbetuximab(IMAB362)是一类针对Claudin 18.2靶点的单克隆抗体药物。在2016年ASCO大会上公开的数据中,采用Zolbetuximab+CAPOX化疗方案治疗局部晚期或转移性胃癌患者,中位无进展生存期为7.9个月,中位总生存期13.2个月;明显长于仅采用CAPOX化疗方案的4.8个月和8.4个月。
在2019年公开的Ⅱ期研究数据中也证实,Zolbetuximab治疗晚期胃癌或胃食管交界处癌或食道腺癌患者,临床获益率达到23%。
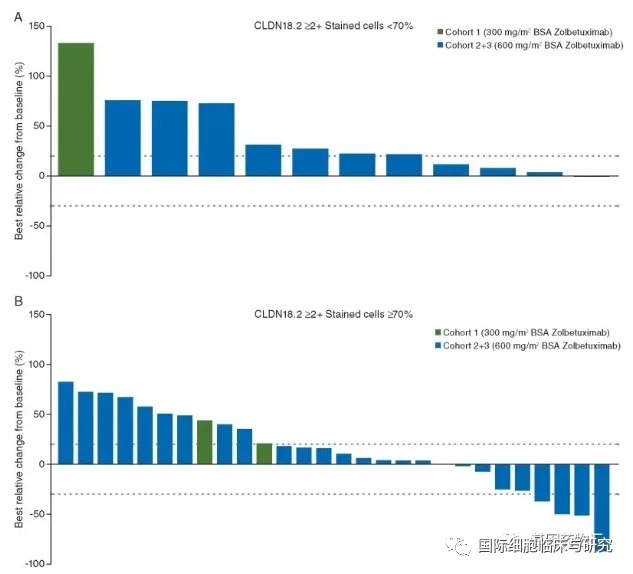
目前,Zolbetuximab已经获得FDA的批准进行Ⅲ期临床试验,有望尽快得到更有价值的大型疗效数据。近期,Zolbetuximab治疗局部晚期不可切除或转移性胃及胃食管交界处腺癌患者的临床试验获得国家药品监督管理局批准,正式开始在中国招募患者。
适应症
局部晚期不可切除或转移性胃及胃食管交界处腺癌
纳入标准
成年患者,年龄≥18岁;
经组织学证实诊断为胃或胃食管交界处腺癌;
接受临床试验前28天内经影像学证实为局部晚期不可切除或转移性疾病;
接受临床试验前28天内,根据RECIST1.1,经当地医院或医疗机构评估为放射学可评估的疾病(可测量和/或不可测量)。对于仅有1个可评估病灶且在随机化前≤3个月曾接受过放疗的患者,病灶必须在既往放疗区域外或在放疗后仍然进展;
受试者的肿瘤有≥75%肿瘤细胞表达CLDN18.2,中心实验室IHC检测确定有中至重度膜染色;
HER2阴性;
ECOG评分为0或1分;详细纳入标准可咨询全球肿瘤医生网医学部。
排除标准
既往曾接受针对局部晚期不可切除或转移性胃及胃食管交界处腺癌的全身性化疗的患者;
开始试验前≥6个月接受新辅助化疗或辅助化疗的患者可以参与试验;
既往曾接受针对局部晚期不可切除或转移性胃及胃食管交界处腺癌的放疗,且在接受临床试验前14天内相关毒性未恢复的患者;
接受临床试验前28天内曾接受任何已知的具有抗肿瘤活性的草药或其他治疗的患者;
接受临床试验前14天内曾接受全身性免疫抑制疗法的患者;
详细排除标准可咨询全球肿瘤医生网医学部。
02、国内版"雷莫芦单抗"开启临床招募
雷莫芦单抗是一种血管生成抑制剂,它是一种血管内皮生长因子(VEGF)受体2拮抗剂,通过特异性结合该位点,阻止VEGF受体的配体VEGF-A、VEGF-C和VEGF-D结合,从而阻止VEGF受体2的激活。
在一项由355名不能切除或转移性胃癌或胃食管交界处腺癌受试者参与的临床试验中,三分之二的受试者接受Cyramza雷莫芦单抗治疗,结果显示雷莫芦单抗与安慰剂受试者的平均总生存期为5.2个月,明显长于安慰剂组3.8个月。
2014年4月,雷莫芦单抗(Cyramza)获美国食品药品管理局(FDA)批准上市,用于进展期胃癌或胃食管连接部腺癌患者治疗。
但雷莫芦单抗尚未在国内获批,每月约6万元的治疗费用以及国外药物极高的获取难度,仍使众多患者望而却步,丧失治疗良机。
为了解决这一难题,也为了改善胃癌患者的生存质量,我国药企针对雷莫芦单抗相同靶点人血管内皮生长因子受体2(VEGFR2/KDR)进行深入研究、攻坚克难,研制出了“国产版雷莫芦单抗”(Me-Too产品)金妥昔单抗,为胃癌患者生存助力!
目前,金妥昔单抗在国内的Ⅰb/Ⅱ期临床研究已经展开,计划招募76例晚期胃及胃食管结合部腺癌患者,挑战二线治疗方案!
此次试验主要研究金妥昔单抗二线治疗晚期复发及转移性胃癌患者的药代动力学及耐受性,所有参与临床试验的患者均接受金妥昔单抗联合紫杉醇治疗,不设置空白对照组。全国多家大学附属医院同步进行,患者可以就近接受治疗。
纳入标准:
年龄18~75周岁,性别不限;
经组织学诊断的晚期或转移性胃或胃食管结合部腺癌患者,且既往接受过含铂类联合氟尿嘧啶类药物一线化疗期间或治疗结束后3个月内疾病进展(辅助或新辅助治疗期间或治疗结束后6个月内疾病进展的受试者可以入组);
根据RECIST1.1实体瘤疗效评价标准至少有一个可测量病灶(即存在实体病灶);
ECOG体力状况评分0~1分;骨髓储备、肝功能、肾功能、凝血功能基本正常;
有生育能力的受试者,在研究期间和末次给药后的3个月期内,同意采取有效避孕措施,且女性入组时血妊娠试验阴性详细入
排标准可咨询全球肿瘤医生网医学部。
03、免疫联合疗法初涉胃癌
Sitravatinib是一种酪氨酸激酶抑制剂(TKIs)类药物。Sitravatinib旨在阻断特定蛋白质(认为该蛋白质会促进肿瘤生长),并阻止新血管生长,通过调节患者的免疫机制及肿瘤微环境,改善免疫系统识别和攻击癌细胞的能力。
Tislelizumab(替雷利珠单抗)是国内某药企研发的PD-1单克隆抗体。阻断PD-1与配体的结合,从而消除对免疫细胞的抑制作用,Tislelizumab不会结合吞噬细胞表面某些特殊蛋白(Fc gamma受体),从而避免了结合抗PD-1抗体的免疫细胞被吞噬细胞错误清除。
两种免疫抑制剂联合用于胃癌的试验已正式在国内展开。
试验名称
探索Sitravatinib单药以及与Tislelizumab联合用药在不可切除的局部晚期或转移性肝细胞癌或胃癌/胃食管结合部癌患者中的I/II期研究
试验目的
主要和次要目的:
评价单药及联合用药的安全性,耐受性及初步抗肿瘤活性;确认RP2D(仅I 期);评价单药治疗及联合用药时Sitravatinib的PK特征。
探索性目的:
探索肿瘤组织和外周全血中潜在生物标志物;探索潜在药效动力学生物标志物;评价联合用药时Tislelizumab的PK和免疫原性;探索遗传药理学多态性对Sitravatinib PK的影响(仅I期);评价总生存期(仅II期)。
目标入组人数:中国94人
截至时间:入组所需人员招满为止
入选标准(部分)
能够提供书面知情同意书,且能够理解并遵守本研究的要求和评估时间表;
签署知情同意书当天已年满18岁(或研究发生管辖权下的法定承诺年龄);
RECIST v1.1定义的至少1个可测量病灶;同意提供存档肿瘤组织及血液样品用于分子分析;ECOG体力状况评分≤1;
充足的血液学和终末器官功能;同意采取高效的避孕措施;
经组织或细胞学证实的不可切除的局部晚期或转移性肝细胞癌:未接受过抗PD-1/PD-L1抗体治疗的肝细胞癌,曾经接受过标准治疗的肝细胞癌,抗PD-1/PD-L1抗体难治性/耐药性(R/R)肝细胞癌;
经组织或细胞学证实的局部晚期不可切除或转移性G/GEJ癌:
未接受过抗PD-1/PD-L1抗体治疗的HER2 阴性G/GEJ癌;
详细入排标准可咨询全球肿瘤医生网医学部。
04、靶向claudin18.2的 CAR-T疗法进军胃癌
继CAR-T疗法疗法在白血病和淋巴瘤患者中获批后,胃癌和胰腺癌患者也迎来喜讯,CAR-T疗法向实体瘤发起攻坚战,实体瘤患者有望获得长久生存期。
CAR-Claudin18.2 T细胞疗法是国际上首个针对 Claudin18.2 的 CAR-T 细胞,由我国科研人员研发。Claudin18.2(CLDN18.2)是一种胃特异性膜蛋白,被认为是胃癌和其他癌症类型的潜在治疗靶点。
2019 ASCO年会上,CAR-Claudin18.2 T 细胞治疗胃癌/胰腺癌的临床数据显示,12例转移性腺癌(胃癌7例、胰腺癌5例)患者未发生严重不良事件、治疗相关死亡或严重神经毒性。
11例可评估对象中:
1例(胃腺癌)完全缓解;
3例(胃腺癌2例胰腺腺癌1例)部分缓解;
5例病情稳定;
2例病情进展;
总客观缓解率为33.3%。
并且,CAR-Claudin18.2 T 细胞治疗胃癌的临床前研究成果显示,靶向Claudin18.2的CAR-T细胞在小鼠模型中可以完全清除胃肿瘤,且没有发生脱靶毒性。
目前,这项试验已经率先由国内胃肠道肿瘤享负盛名的北京大学肿瘤医院胃肠肿瘤科开展,评估自体人源化抗claudin18.2嵌合抗原受体T细胞在晚期实体瘤中的安全性及功效,具体入排标准可向全球肿瘤医生网咨询,我们会全力给予帮助。
入组标准(部分)
年龄18至75岁,男性或女性;
患有病理证实的实体瘤(即晚期胃癌,食管胃交界癌和胰腺癌)并且经标准治疗失败的受试者;
Claudin 18.2 IHC染色阳性;
预计寿命> 12周。