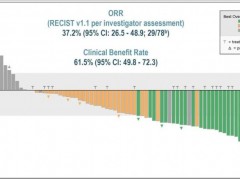
CLDN18.2靶向药,国产多款Claudin18.2靶向药治疗胃癌、胰腺癌、食管腺癌疗效优异,更多的CLDN18.2临床试验招募正在进行中
每年的11月是胃癌宣传月,11月29日是我国的“胃癌关爱日”。作为人口大国,我国也是胃癌重灾区。尽管40年来全球胃癌发病率有所下降,但是发病率仍然居世界第5位,病死率居第3位。超过70%的胃癌新发病例在发展中国家,主要集中在我国。去年大家熟悉的TVB金牌老戏骨廖启智就是因胃癌去世。
今天无癌家园小编就给各位癌友们详细介绍下近期在胃癌治疗领域有突出研究成果的多款Claudin 18.2药物,实际上不仅局限在胃癌领域,在胰腺癌、食管腺癌等难治性癌种方面,Claudin 18.2药物也在持续发力,收获颇丰!
流行病学数据揭示"中国式"胃癌,现状不容乐观
从流行病学数据来分析,“中国式”胃癌仿佛一座无形的大山压在国人心头无法喘息。
在2022年2月27日国家癌症中心公布的中国最新癌症报告中,胃癌更是跻身高发癌症和死亡率最高的癌症的前三甲,其中,高发癌症位列前三位的分别是肺癌(82.8万)、结直肠癌(40.8万)、胃癌(39.7万)。死亡率位列前三位的癌症分别是肺癌(65.7万)、肝癌(33.6万)、胃癌(28.9万)。
由于胃癌患者早期缺乏典型的症状,难以自查,一旦确诊已处于晚期,超过70%的胃癌患者就诊时已为晚期,失去了手术的机会。
而且胃癌整体预后较差,5年生存率仅10%~30%,晚期胃癌患者5年生存率低于10%,晚期胃癌一线治疗的研究结果显示,总生存期(OS)在不断延长,但中位生存期仍在12个月左右。
晚期胃癌传统的治疗方法有手术、放疗和化疗,但对于晚期胃癌手术治愈率低,且放化疗疗效欠佳。
一句话概括,中国胃癌治疗形势严峻!
基于此,众多研究人员纷纷将目光锁定在Claudin 18.2身上,这个靶标的发现也翻开了胃癌靶向治疗的新篇章。
内卷升级!国产多款Claudin18.2药物获批临床,持续发力
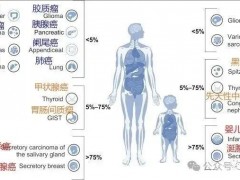
Claudin18.2(CLDN18.2)是Claudin蛋白质家族的一员,位于细胞膜表面,正常情况下仅低水平表达于胃粘膜分化上皮细胞,但在病理状态下,Claudin18.2在多种肿瘤中有的表达显著上调,包括80%的胃肠道腺瘤、60%的胰腺肿瘤。此外,CLDN 18.2活化还可见于食管癌、卵巢癌和肺腺癌中,因此是具有潜力治疗癌症的热门靶点。
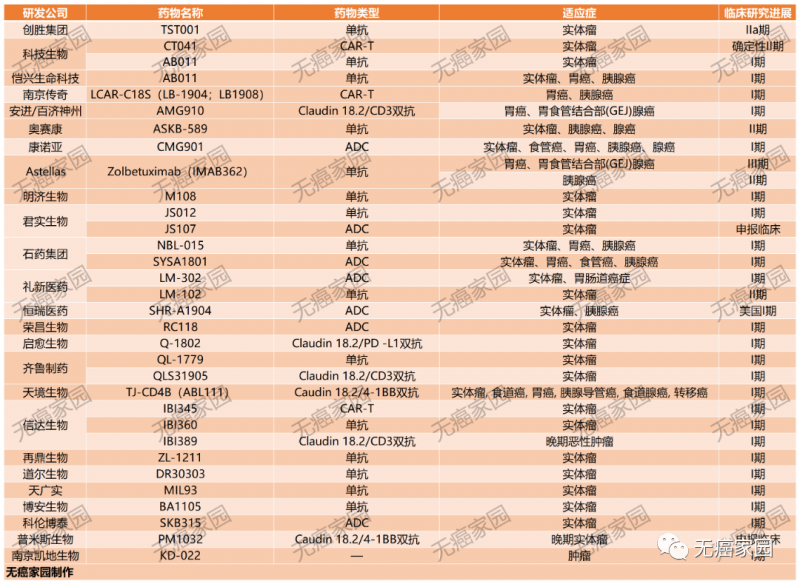
据无癌家园小编查阅ClinicalTrials及CDE(国家药监局)发现,目前批准临床的Claudin18.2产品就多达几十款,多数药物均是拟用于治疗晚期胃癌、胰腺癌及实体瘤患者。
因该靶点在正常组织中的高度特异性表达,再加上在多种癌症中的激活表达,使得Claudin18.2蛋白成为了研究人员开发胃癌、胰腺癌等实体瘤免疫疗法的理想靶点。同时,由于胃癌是国内的一大瘤种,Claudin 18.2靶点有望实现胃癌新靶点药物的瓶颈突破。
目前,已经开发出用于癌症免疫治疗的靶向CLDN18.2 的不同治疗剂,包括单克隆抗体、双特异性抗体 (BsAb)、重定向至靶向 CLDN18.2 的嵌合抗原受体 T (CAR-T) 细胞和抗体-药物偶联物 (ADC)。
01、单抗药物
勇争靶点"高地",新药Zolbetuximab使超半数患者受益
Zolbetuximab(IMAB362)是一类针对Claudin 18.2靶点的单克隆抗体药物。
在目前所有被批准进入临床试验的靶向Claudin18.2药物中,研发进度最快的也是Zolbetuximab。
在2016年ASCO大会上公开的数据中,采用Zolbetuximab+CAPOX化疗方案治疗局部晚期或转移性胃癌患者,中位无进展生存期为7.9个月,中位总生存期13.2个月;明显长于仅采用CAPOX化疗方案的4.8个月和8.4个月。
在2019年公开的Ⅱ期研究数据中也证实,Zolbetuximab治疗晚期胃癌或胃食管交界处癌或食道腺癌患者,临床获益率达到23%。同时,从分组分析中可以明显观察到,Zolbetuximab对于Claudin 18.2表达水平更高、尤其是表达水平≥70%的患者疗效更加显著。
据最新消息称,2022年11月16日,CLDN18.2 单抗 Zolbetuximab 已在全球范围内的Ⅲ期临床试验 SPOTLIGHT 研究中取得了积极结果,达到了无进展生存率(PFS)主要终点和总生存率(OS)次要终点,结果均有统计学意义。同时,这也是首个关于 CLDN18.2 靶点的成功的Ⅲ期临床成功。
该项研究入组了566例CLDN18.2阳性、HER2阴性、局部晚期不可切除性或转移性胃或胃食管交界(GEJ)腺癌患者,旨在评估zolbetuximab联合mFOLFOX6(奥沙利铂、亚叶酸 + 氟尿嘧啶联合方案)一线治疗的疗效及安全性。
研究结果显示,与安慰剂联合mFOLFOX6相比, Zolbetuximab联合mFOFOX6治疗的患者无进展生存率和总体生存率均达到研究终点,并且具有统计学差异。
而2021年ASCO大会上公布的临床II期研究数据显示,Zolbetuximab联合mFOLFOX6一线治疗转移性或局部晚期不可切除G/GEJ的成年患者,在19例可评估的患者中,12例患者为部分缓解,客观缓解率高达63.2%。中位无进展生存期为13.7个月,1年中位无进展生存率为58%!
我国自主研发的首个针对Claudin18.2的单抗,AB011临床招募来袭
AB011是一款重组人源化抗Claudin18.2单克隆抗体注射液,这是我国自主研发的首个针对Claudin18.2的单抗,也是国际上首个针对该靶点的人源化单抗。
临床前研究结果显示AB011有良好的安全性和有效性。当与奥沙利铂和5-氟尿嘧啶联合使用时,在肿瘤小鼠模型中表现出强大的体内抗肿瘤活性。
目前AB011的单药治疗阶段已观察到有既往接受二线化疗失败的晚期胃癌患者达到完全缓解(CR)。在联合治疗阶段,首例晚期胃癌患者首次用药后6周肿瘤评估为部分缓解(PR),同时各项肿瘤指标也有显著下降,均恢复到正常值以下,患者精神状态较治疗前有明显好转。
其他进入临床试验的单抗药物
01、TST001
TST001是我国自主研发的Claudin18.2人源化单克隆抗体新药,可通过高亲和力特异性结合Claudin18.2蛋白,介导ADCC和CDC机制,直接靶向杀灭Claudin18.2表达阳性的肿瘤细胞。
2020年4月,TST001先后在中国、美国获批临床试验。在中国,TST001获批为拟在临床试验中单药或联合标准治疗用于治疗Claudin18.2表达阳性的晚期实体瘤,包括但不限于胃/胃食管结合部腺癌,胰腺导管腺癌,胆管癌,胆囊癌,肺腺癌等。目前,TST001正在美国及中国进行1期临床试验。
02、M108单抗注射液
M108为Claudin 18.2单抗,是我国自主研发针对胃癌等消化系统癌症肿瘤抗原高表达的ADCC增强型单克隆抗体。
与常规抗体药物相比,M108单抗注射液充分利用抗体的免疫学抗肿瘤机制,通过增强型的ADCC效应充分调动患者机体的免疫细胞来杀伤肿瘤细胞。在体外和体内的抗体药效及理化性质等检测中,M108单抗注射液展示了较高的靶点特异性结合、较强的抗肿瘤活性和很好的安全性。
03、NBL-015
NBL-015是一种全人源抗Claudin-18.2单克隆抗体,经过蛋白工程改造获得优化的ADCC,CDC和ADCP效应。临床前体外细胞杀伤实验、动物胰腺癌肿瘤消除实验及毒性研究均显示NBL-015较同类药物具有免疫原性低、安全性好、亲和力强、抗肿瘤活性高的显著优势,有望成为同类最佳治疗胰腺癌和胃癌的靶向药物。
02、CAR-T疗法
随着2021年阿基仑赛注射液、瑞基奥仑赛注射液先后在中国获批上市,2022年西达基奥仑赛获美国FDA批准上市,CAR-T疗法已然进入井喷期。尤其是在多种血液肿瘤领域,如白血病、淋巴瘤、多发性骨髓瘤等癌种中,表现出不俗的疗效,让许多濒临绝境、无药可治的血癌患者,一大半都获得了良好的疗效。
然而面对占比90%以上的实体瘤,近年来CAR-T疗法在胃癌、肝癌、胰腺癌、肠癌等领域都有着卓越的进步。国内外的学者更是针对CAR-T进行了多种改造,不断地发现新靶点,以用于治疗多种实体肿瘤。
CT041
作为国际上首个针对Claudin18.2的CAR-T细胞,CT041从2019年首次亮相就惊艳世界,其显著的疗效展现出对消化系统肿瘤的良好治疗前景。
2022年5月9日,科济药业CAR-T细胞产品CT041治疗消化系统肿瘤的研究结果发表在国际顶级期刊《Nature Medicine》杂志上,这也算是首个发表于顶级学术期刊的迄今为止最大样本量的CAR-T细胞治疗实体瘤的临床研究!
研究数据显示
1.所有患者的客观缓解率达48.6%,疾病控制率达73%;所有胃癌患者总客观缓解率为57.1%,疾病控制率达75.0%。
2.既往接受至少2线治疗失败的胃癌患者:客观缓解率为61.1%,疾病控制率为83.3%。
在此次ASCO大会上,科济药业展示了两篇关于CT041的研究成果,包括:
(1)在美国进行的针对晚期胃癌和胰腺癌患者的多中心1b期试验的结果:
截止2022年5月6日,已有14例患者入组,包括既往接受过至少两种前线系统治疗的5例胃癌/食管胃结合部腺癌(GC/GEJ)患者以及至少接受过一种前线治疗的9例胰腺癌患者。
在胃癌/食管胃结合部腺癌患者的分组中,客观缓解率(ORR)为60%,其中完全缓解(CR)1例。此外,约80%(4/5)的疾病稳定(4例胰腺癌患者)患者中观察到了肿瘤的缩小。
中位缓解持续时间及中位无进展生存期均未达到。在DL1中观察到的客观缓解率(ORR)为16.7%,疾病控制率(DCR)为50%。在DL2中观察到的客观缓解率为33.3%,疾病控制率为83.3%。
此项临床试验数据显示,与历史治疗方案相比,CT041在既往接受多线治疗的胃癌患者中可能有显著的抗肿瘤活性改善。
(2)在中国进行的针对晚期胃癌/食管胃结合部腺癌患者的Ib/II期试验的安全性和初步疗效结果:
截止到2021年12月22日,14例胃癌/食管胃结合部腺癌患者纳入Ib期,其中57.1%的患者转移器官数目≥3个,92.9%存在腹膜转移。大多数患者(85.7%)之前接受过二线治疗或包含氟尿嘧啶、奥沙利铂和紫杉醇的三联疗法治疗。35.7%的患者曾接受过PD-1/PD-L1抑制剂治疗。
最后有13例患者可进行肿瘤评估,1例患者退出评估。14例患者中有8例(57.1%)在CT041首次输注后的首次肿瘤评估即达到部分缓解,基于研究者评估客观缓解率和疾病控制率分别为57.1%和78.6%。
中位随访时间为8.8个月,中位无进展生存期(mPFS)和中位总生存期(mOS)分别为5.6个月和10.8个月。至数据截止日期,有7例患者仍然存活。
初步研究结果表明,CT041在接受晚期胃癌/食管胃结合部腺癌患者中具有显著疗效及可控的安全性。
LY011
LY011是一种抗CLDN18.2的第三代CAR-T细胞产品。给药后,LY011 特异性识别并结合表达 CLDN18.2 的肿瘤细胞,导致特异性细胞毒性 T 淋巴细胞 (CTL) 介导的对表达 CLDN18.2 的肿瘤细胞的杀伤。
目前,有两项正在进行的 I 期临床试验在 CLDN18.2 阳性的胰腺癌和晚期胃癌患者中进行。
根据 2021 年 1 月 31 日的报告,4例晚期恶性实体瘤患者(胃癌3例,胰腺癌1例)已完成DLT观察期并接受首次药物治疗。根据RECIST 1.1评价标准,4名受试者中,2名受试者的疾病缓解(PR)和2名受试者的疾病稳定(SD)的最佳疗效。报告发布时,客观缓解率为50.0%(2/4),疾病控制率(DCR)为100%(4/4)。在最低剂量组中,1×106个CAR-T细胞/kg,客观缓解率为66.67%(2/3),疾病控制率为100%(3/3)。
这些初步数据表明,LY011 在晚期恶性实体瘤受试者中安全且耐受性良好,具有良好的抗肿瘤作用。需要进行更多的临床研究。
LCAR-C18S
LCAR-C18S是南京传奇生物科技有限公司开发的靶向CLDN18.2的CAR-T细胞疗法。它已进入治疗胃癌和胰腺癌的I期临床试验,以确定其安全性、耐受性和有效性。此外,更多的候选药物已由其他公司开发,并处于临床前或早期临床研究阶段,临床研究结果正在等待中。
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性淋巴细胞白血病、非霍奇金淋巴瘤、肝癌、胃癌、前列腺癌、甲状腺癌、间皮瘤、卵巢癌等癌种!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!
截至目前,国内开展的CAR-T临床试验数量已经超过500项,居世界第一,这也是中国首次在一个新药研发领域走到国际前列。其中,传奇生物的西达基奥仑赛、斯丹赛生物的GCC19CART、科济药业的Claudin18.2 CAR-T都达到全球领先水平。此外,还有多公司在布局新一代CAR-T以及异体CAR-T技术,初步数据优异,有望获得全球市场。
2021年我国迎来了细胞免疫治疗的元年,作为先锋的CAR-T疗法,是未来发展方向之一。CAR-T疗法主要在于改造T细胞来使其识别肿瘤细胞的特殊靶点,理论上,可以有无数种针对不同靶点的CAR-T疗法,这意味着蕴含着无限可能。
03、双抗药物
01、AMG910
AMG910是我国自主研发的一款靶向CD3/Claudin18.2的双特异性抗体药物。在全球范围内,安进正在开展一项1期临床研究,以评估AMG 910治疗Claudin18.2阳性的胃癌和胃食管交界腺癌患者的安全性、耐受性、药代动力学和疗效。
02、Q-1802冻干粉针
Q-1802是启愈生物利用其抗体工程技术平台自主开发并具有自主知识产权的可以同时靶向PD-L1及Claudin18.2的双特异性抗体。根据动物临床前研究显示,Q-1802药效优于PD-L1抗体和Claudin18.2抗体的联用。目前,该药物已获批进入临床。
04、ADC药物
01、CMG901
CMG901是一种靶向CLDN 18.2的ADC,由三部分组成:靶向 CLDN18.2 的单克隆抗体、可切割的接头和有效的细胞毒性有效载荷 (MMAE)。临床前研究表明,CMG901 可以有效杀死胃癌细胞,其抗肿瘤效力比 zolbetuximab 类似物或 CMG901非偶联抗体强得多。CMG901 在临床前研究中也表现出良好的耐受性和良好的安全性。CMG-901 已被 FDA 批准用于 GC/GEJ 癌症患者的 I 期临床试验。
02、SYSA-1801
SYSA-1801是一种全人源单克隆抗体加 MMAE 药物偶联物,靶向 CLDN18.2。
临床前研究表明,SYSA1801对胃癌、胰腺癌和肺癌具有优异的体内外活性和良好的安全性,表明它是一种很有前途的药物,在临床试验中具有良好的疗效。
SYSA-1801 已获 FDA 和 CDE 批准在美国和中国进行临床试验,分别用于 GC/GEJ 癌症和 CLDN18.2 表达的 PC 患者。
03、RC118
RC118 是一种靶向 Claudin18.2 的 ADC,已用于治疗局部晚期不可切除或转移性恶性实体瘤。RC118 于 2021 年 11 月在澳大利亚的患者中首次进行了 I 期临床试验,并且还在美国进入了 I/II 期研究 (NCT05205850)。RC118 正在进行 I 期临床研究,用于治疗患有各种类型实体瘤的 CLDN18.2 阳性患者。此外,更多的候选药物,如CPO102-US-101和LM-302,正在临床试验中进行评估。
小编有话说
从上述小编列举的在研药物来看,Claudin18.2靶点作为胃癌领域下一代非常有潜力的靶点,成为各方角逐的重点,光2021-2022年在中国开展的临床试验数量已经超过美国,位列全球第一。
相信在未来,随着靶向药研究的不断进展,会有更多热门靶点及靶向药物诞生,为更多罹患恶性肿瘤的患者带来长生存的新希望。
如果您对于目前的治疗方案有疑问,或者想要咨询更合适的治疗方案,请联系无癌家园医学部申请国际会诊。
胃癌专家会诊推荐


参考文献
1.https://www.prnewswire.com/news-releases/carsgen-receives-cta-authorization-from-health-canada-for-cldn18-2-targeted-car-t-cell-product-ct041--301429649.html
2.https://newsroom.astellas.us/2022-11-16-Astellas-Announces-Zolbetuximab-Meets-Primary-Endpoint-in-Phase-3-SPOTLIGHT-Trial-as-First-Line-Treatment-in-Claudin-18-2-Positive,-HER2-Negative-Locally-Advanced-or-linkstatic-Gastric-and-Gastroesophageal-Junction-GEJ-Cancers