小细胞肺癌新药,FDA批准Tarlatamab-dlle(塔拉妥单抗、Imdelltra)用于治疗在铂类化疗期间或之后疾病进展的广泛期小细胞肺癌(ES-SCLC)
2024年5月16日,肺癌圈迎来一个重磅消息!美国食品和药物管理局(FDA)加速批准IMDELLTRA ™(Tarlatamab-dlle),用于治疗在铂类化疗期间或之后疾病进展的广泛期小细胞肺癌(ES-SCLC)成年患者。Tarlatamab是目前首个也是唯一一款获批用于治疗侵袭性肺癌的DLL3靶向双特异性T细胞接合疗法。FDA的本次获批逆转了小细胞肺癌无药可用的困境,标志着小细胞肺癌治疗领域的一个重要里程碑,为患者带来了新的选择与曙光!
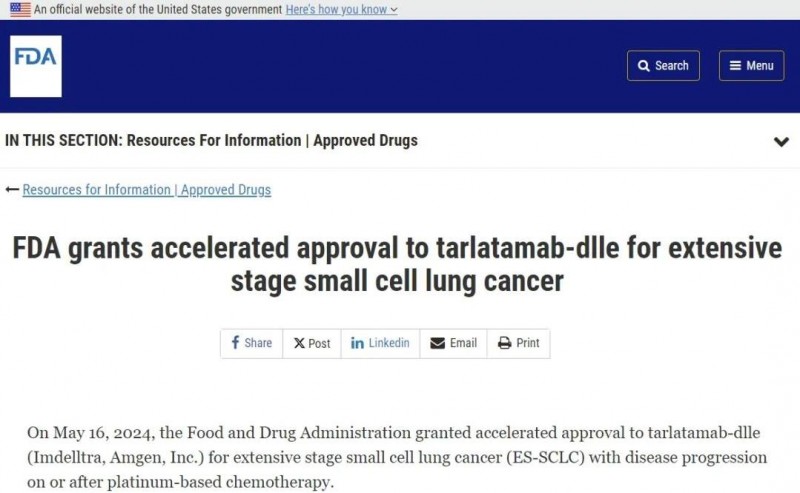
▲截图源自“FDA官网”
小细胞肺癌终于迎来重磅新药Tarlatamab
小细胞肺癌(SCLC)约占肺癌的15%,是最具破坏性和侵袭性的恶性肿瘤之一,尽管大多数广泛期小细胞肺癌患者对初始治疗有反应,但患者很快就会复发并需要后续的治疗。且既往并无获批的三线治疗方案,患者平均生存期仅为1年左右,晚期患者的五年生存率仅为7%。
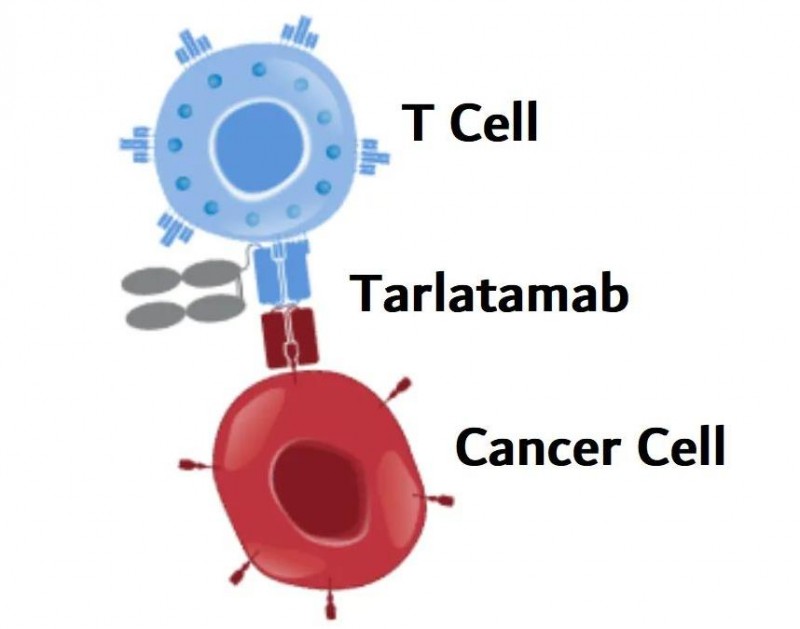
Tarlatamab是一种双特异性T细胞接合剂(BiTE)的免疫治疗方法,可与癌细胞上的DLL3(δ样配体3)、CD3结合,并将患者的T细胞,引导至表达DLL3的癌细胞,从而帮助T细胞识别并摧毁癌细胞。
▲图源“NIH”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
其中,DLL3是一种抑制Notch信号传导的蛋白质,通常情况下位于正常细胞的内部,但在85%~94%的小细胞肺癌(SCLC)的细胞表面异常表达,使其成为治疗小细胞肺癌的潜在靶点。
Tarlatamab:客观缓解率提高近一倍
Tarlatamab本次获批是基于2期DeLLphi-301临床试验的结果,该结果在2023年欧洲肿瘤内科学会(ESMO)年会上公布,数据同步发表在《新英格兰医学杂志(NEJM)》上。
本次研究共入组220例年龄≥18岁,既往接受过一种铂类治疗方案和至少一种其他疗法后,复发或难治的小细胞肺癌患者。这些患者分别接受10mg/2周或100mg/2周剂量的Tarlatamab治疗。经过10个月左右的中位随访(10mg组的中位随访时间为10.6个月,100mg组为10.3个月),结果显示如下:
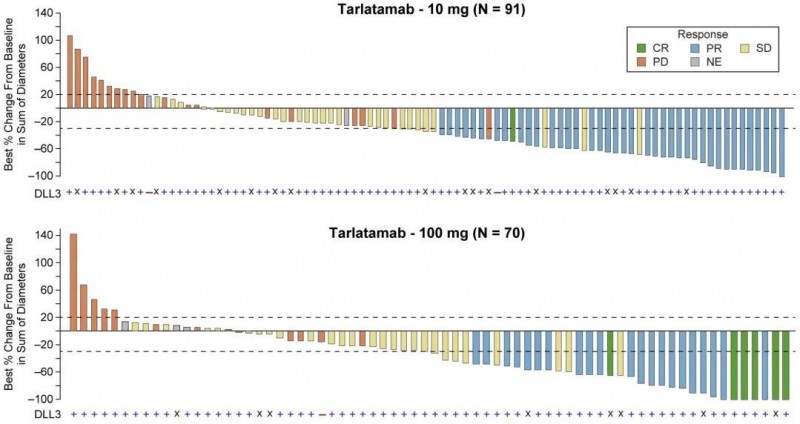
1、客观缓解率(ORR):在可评估抗肿瘤活性和生存率的患者中,100mg组中客观缓解率(ORR)达到32%,10mg组中客观缓解率(ORR)更是达到40%!而既往接受标准法治疗复发的小细胞肺癌患者其客观缓解率仅有15%。显然,接受Tarlatamab治疗的客观缓解率远超传统疗法,ORR提高了一倍多。
图1 Tarlatamab的抗肿瘤活性
▲图源“NEJM”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
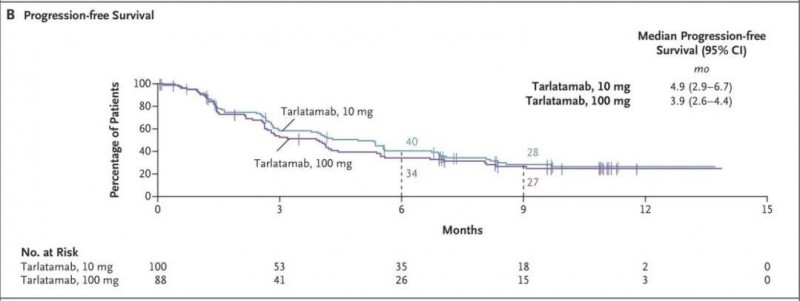
2、无进展生存期(PFS):10mg组患者的中位无进展生存期(PFS)为4.9个月,100mg组的中位无进展生存期(PFS)为3.9个月。
▲图源“NEJM”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
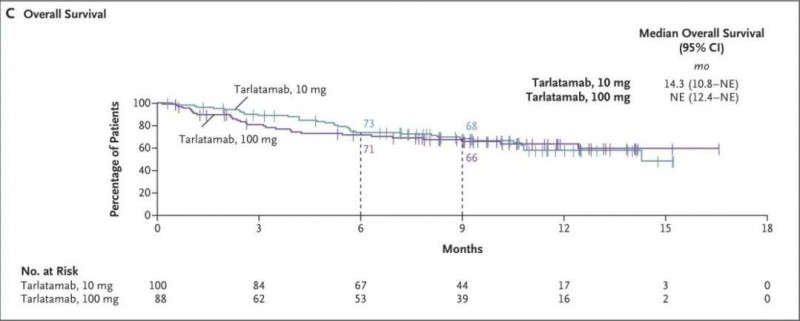
3、总生存率(OS):治疗9个月时,患者的总生存率估计分别为68%(10mg组)、66%(100mg组)。
▲图源“NEJM”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
4、常见不良反应:用药后常见的不良反应包括细胞因子释放综合征(1/2级)、食欲下降、发热。
综上,Tarlatamab显示出抗肿瘤活性,具有持久的客观反应,且对既往接受过治疗的小细胞肺癌患者,具有良好的生存结果。
中国患者如何寻求Tarlatamab帮助
好消息是,小细胞肺癌这款重磅新药-Tarlatamab(塔拉妥单抗),已在国内启动Ⅲ临床研究,国内多中心正在招募1种含铂方案治疗后,病情进展或复发的小细胞肺癌患者。
想参加临床研究的病友可联系医学部,了解详细的入排标准。或将电子版诊断报告、完整的病理报告等资料,发送至邮箱:doctor.huang@globecancer.com,并在邮件中留下联系方式。全球肿瘤医生网医学部会在收到报告分析完毕后1个工作日内电话联系。