2024年速看,27类重磅抗癌抗肿瘤新药纳入国家药监局优先评审,肺癌、肠癌、胃癌等十余种常见癌症迎来救命药
在抗癌领域的不懈探索中,2024 年迎来了令人瞩目的进展,据中国国家药品监督管理局药品审评中心(NMPA)官网公示信息,2024年共有27款重磅抗癌新药的上市申请正式被纳入优先审评。药品上市许可优先审评审批是国家为鼓励研究和创制新药、解决临床急需短缺药品等问题,而设立的药品快速上市通道。这也意味着这些药物的审评时限会大幅缩短,有望尽快上市。
这些新药涵盖了多发性骨髓瘤、非小细胞肺癌、子宫内膜癌、结直肠癌等多种癌症类型,这无疑为广大癌症患者带来了更多的治疗选择和生存希望,也标志着全球医药研发在攻克癌症征程上的重要里程碑!下面全球肿瘤医生网小编就为大家简单盘点一下这些新药,以供癌友们参考。
2024年纳入优先评审的27款抗癌新药大盘点
01、注射用芦康沙妥珠单抗
药品信息
①药物名称:芦康沙妥珠单抗(佳泰莱®,Sacituzumab tirumotecan,SKB264,Sac-TMT)。
②研发公司:科伦博泰生物。
③治疗靶点:TROP2。
④适应证:非小细胞肺癌、尿路上皮癌、乳腺癌。
药物介绍
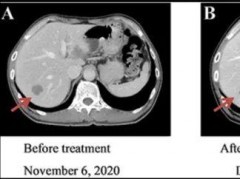
芦康沙妥珠单抗(SKB264)是我国自研的一款靶向TROP2的抗体偶联药物(ADC药物),2024年10月31日,该药的新适应症上市申请,获中国国家药监局药品审评中心(NMPA)首例,用于EGFR突变的局部晚期或转移性非小细胞肺癌的治疗。此外,该药还被纳入纳入优先审评(CXSS2300093),用于局部晚期或转移性三阴性乳腺癌的治疗。
2024年ASCO大会上,公布了“芦康沙妥珠单抗治疗晚期非小细胞肺癌(NSCLC)的2期OptiTROP-Lung01临床研究数据”。结果显示:芦康沙妥珠单抗联合KL-A167联合治疗后,客观缓解率(ORR)高达77.6%,6个月中位无进展生存(PFS)率高达84.6%(详见下表)。
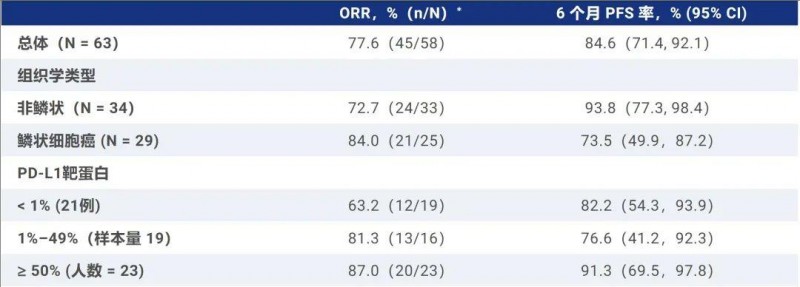
▲数据源自“ASCO”,全球肿瘤医生网医学部整理汇总
02、注射用Belantamab mafodotin
药品信息
①药物名称:Belantamab Mafodotin(玛贝妥单抗,Blenrep®)。
②研发公司:葛兰素史克(中国)。
③治疗靶点:BCMA。
④适应证:多发性骨髓瘤。
药物介绍
玛贝妥单抗是一款靶向BCMA的抗体偶联药物(ADC药物),2020年先后获得美国食品药品监督管理局(FDA)、欧洲药品管理局(EMA)批准,用于治疗难治性/复发性多发性骨髓瘤(MM)。值得一提的是,该药是全球首款获批上市的BCMA靶向疗法,同时也是目前唯一获得FDA批准用于复发或难治性多发性骨髓瘤治疗的ADC药物。但遗憾的是,后续因不符合FDA标准,已在2022年从美国市场撤出。
03、SHR2554片
药品信息
①药物名称:SHR2554片。
②研发公司:恒瑞医药。
③治疗靶点:EZH2。
④适应证:复发或难治性外周T细胞淋巴瘤。
药物介绍
SHR2554片是一种针对 EZH2 的口服抑制剂,而EZH2 是淋巴瘤的合理治疗靶点,值得一提的是,该药也是国内首个进入临床的EZH2抑制剂表观遗传药物。“SHR2554片治疗复发或难治性外周 T 细胞淋巴瘤的首次人体 I 期研究”显示,客观缓解率达61%(范围:41–78),中位无进展生存期(PFS)为 11.1 个月,12 个月总生存(OS)率高达92%(范围:72~98)。
04、注射用维迪西妥单抗
药品信息
①药物名称:维迪妥昔单抗(disitamab vedotin,RC48,爱地希®)。
②研发公司:荣昌生物制药。
③治疗靶点:HER2。
④适应证:胃癌、尿路上皮癌、乳腺癌。
药物介绍
维迪西妥单抗是一款靶向HER2的ADC药物,2024年该药的第三个适应症的上市申请,获中国NMPA首例,并被纳入优先审评审批程序,用于HER2阳性(HER2免疫组织化学检查结果为3+或FISH+)的晚期乳腺癌(伴肝转移)的治疗。此前,该药已有两个适应证在我国获批上市,分别用于治疗HER2过表达的局部晚期或转移性胃癌、HER2过表达的局部晚期或转移性尿路上皮癌,并被纳入国家医保目录。值得一提的是,该药是我国获准上市的首款国产ADC药物!同时也是我国首个治疗尿路上皮癌并且靶向HER2的ADC药物。Ⅱ期临床研究显示,治疗HER2阳性局部晚期或转移性尿路上皮(UC)的中位无进展生存期(PFS)达5.9 个月,中位总生存期(OS)长达14.2 个月,总体缓解率(ORR)高达50.5%。
05、注射用维贝柯妥塔单抗
药品信息
①药物名称:注射用维贝柯妥塔单抗(MRG003)。
②研发公司:乐普生物。
③治疗靶点:EGFR。
④适应证:复发或转移性鼻咽癌。
药物介绍
维贝柯妥塔单抗(MRG003)于2024年9月被中国NMPA纳入优先审评,用于复发或转移性鼻咽癌(NPC)的治疗,患者既往经≥二线系统化疗和PD-1/PD-L1抑制剂治疗失败。值得一提的是,该药是进度最快的国产EGFR ADC!I/II期临床研究(NCT05688605)数据显示,在27例可评估疗效的患者中,客观缓解率(ORR)达到63.0%(95%CI:42.4,80.6),疾病控制率(DCR)达到88.9%(95%CI:70.8,97.7)。
06、注射用瑞康曲妥珠单抗
药品信息
①药物名称:瑞康曲妥珠单抗(SHR-A1811)。
②研发公司:盛迪亚生物。
③治疗靶点:HER2。
④适应证:非小细胞肺癌(既往接受过至少一种系统治疗)。
药物介绍
瑞康曲妥珠单抗(SHR-A1811)是一款靶向HER2的抗体药物偶联物(ADC药物),其上市许可申请获中国NMPA首例,并被纳入优先审评程序,用于局部晚期或转移性HER2阳性非小细胞肺癌(NSCLC)的治疗。II期SHR-A1811-I-103临床试验(NCT04818333)数据显示,该药治疗非小细胞肺癌的疾病控制率(DCR)高达95.3%(95% CI 84.2–99.4),客观缓解率达到41.9% (95% CI 27.0–57.9),中位无进展生存期(PFS)为 8.4 个月 (95% CI 7.1–15.0)。
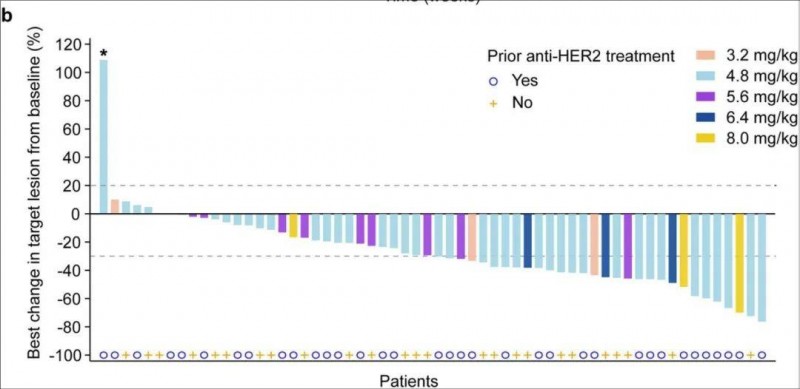
▲图源“PMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
07、甲磺酸阿美替尼片
药品信息
①药物名称:甲磺酸阿美替尼片(阿美乐)。
②研发公司:豪森药业。
③治疗靶点:EGFR。
④适应证:非小细胞肺癌。
药物介绍
甲磺酸阿美替尼片(阿美乐)于2020年3月18日在我国获批上市,该药是继奥希替尼后,全球第二款获批上市的EGFR基因突变肺癌靶向药;同时也是我国第一款三代肺癌EGFR基因突变阳性靶向药。2024年8月20日,该药新适应症的上市申请被中国药品审评中心(CDE),纳入纳入优先审评,用于经含铂放化疗后,病情未进展的不可切除的局部晚期非小细胞肺癌(NSCLC)的治疗。
甲磺酸阿美替尼片治疗局部晚期或转移性非小细肺癌(NSCLC)的1期临床研究(NCT0298110)显示,疾病控制率(DCR)高达92%,客观缓解率(ORR)达52%,中位无进展生存期为11.0个月(详见下图)。
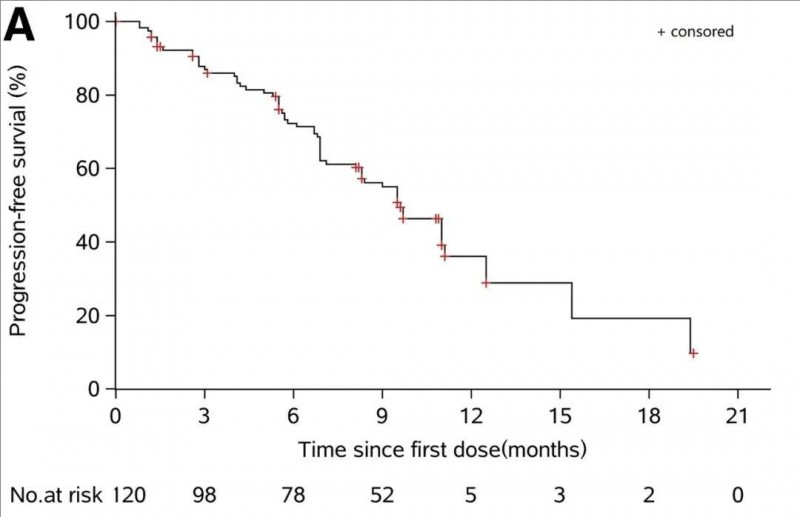
▲图源“JTO”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
08、普基仑赛注射液
药品信息
①药物名称:普基仑赛注射液(pCAR-19B细胞自体回输制剂)。
②研发公司:精准生物。
③治疗靶点:CD19。
④适应证:急性淋巴细胞白血病。
药物介绍
普基仑赛注射液是我国自研的一款pCAR-19B CAR-T细胞产品,其上市申请,已在2024年7月20日,获中国CDE受理,用于CD19阳性复发/难治性的急性淋巴细胞白血病(ALL)的治疗。该药是我国首个进入II期临床治疗儿童和青少年急性白血病的CAR-T疗法。
普基仑赛的1期临床研究(NCT04888442)结果显示,复发/难治性急性淋巴细胞白血病(B-ALL)患者在接受单剂量pCAR-19B治疗1个月内,总有效率(CR/CRi)竟高达100%(9/9)。
09、依沃西单抗注射液
药品信息
①药物名称:依沃西单抗注射液(AK112,Ivonescimab,依达方®)。
②研发公司:康方赛诺医药。
③治疗靶点:PD-1、VEGF。
④适应证:局部晚期或转移性非鳞状非小细胞肺癌。
药物介绍
依沃西单抗注射液是一款国研新型PD-1/VEGF双特异性抗体,具有独特的“肿瘤免疫+抗血管生成”双靶点协同抗肿瘤的作用机制,可阻断VEGF与VEGF受体的结合、PD-1与PD-L1和PD-L2的结合。2024年5月,该药的上市获批,用于经EGFR TKI(表皮生长因子受体-酪氨酸激酶抑制剂)治疗后,病情进展的EGFR阳性局部晚期或转移性非鳞状非小细胞肺癌(NSCLC)的治疗。值得一提的是,依沃西单抗是全球首款获批上市的“肿瘤免疫+抗血管生成”机制的双特异性抗体新药。
好消息是,该药目前在国内多中心开展临床试验,正在招募EGFR耐药的肺癌患者,想申请的病友可将近期病理检查结果、治疗经历等资料,提交至医学部,进行初步评估。
10、甲磺酸奥希替尼片
药品信息
①药物名称:甲磺酸奥希替尼片(AZD9291)。
②研发公司:阿斯利康。
③治疗靶点:EGFR。
④适应证:非小细胞肺癌。
药物介绍
甲磺酸奥希替尼片(AZD9291)是全球首个也是目前唯一一款兼具EGFR突变晚期非小细胞肺癌一线、二线、IB-IIIA期术后辅助治疗的第三代EGFR-TKI(表皮生长因子受体-酪氨酸激酶抑制剂)。好消息是,近日该药又一新适应症被中国CDE纳入优先审评名单,用于含铂放化疗期间或之后病情未出现进展,局部晚期、不可切除的非小细胞肺癌(NSCLC)的治疗。
11、氢溴酸他泽司他片
药品信息
①药物名称:氢溴酸他泽司他片。
②研发公司:和记黄埔医药。
③治疗靶点:EZH2。
④适应证:滤泡性淋巴瘤。
药物介绍
氢溴酸他泽司他片是全球同类首创的EZH2甲基转移酶抑制剂,2024年7月4日,其上市申报申请获中国NMPA受理,此前该药已被纳入优先审评,用于既往接受过至少两种系统性治疗的EZH2突变阳性复发或难治性滤泡性淋巴瘤(FL)成年患者的治疗。
12、注射用坦昔妥单抗
药品信息
①药物名称:注射用坦昔妥单抗(tafasitamab,Monjuvi)。
②研发公司:诺诚健华。
③治疗靶点:CD19。
④适应证:弥漫性大B细胞淋巴瘤。
药物介绍
注射用坦昔妥单抗(Tafasitamab)是一款CD19单抗,可通过免疫效应机制、细胞凋亡,介导B细胞肿瘤的裂解。2024年6月3日,该药被中国NMPA纳入拟优先审评,与来那度胺联合,用于复发或难治性弥漫性大B细胞淋巴瘤(DLBCL)的治疗。此前(2020年8月)坦昔妥单抗已获美国FDA加速获批上市,用于治疗复发或难治性(R/R)弥漫性大B细胞淋巴瘤(DLBCL),它也是美国首个获批的针对DLBCL的二线及二线以上疗法。坦昔妥单抗与来那度胺联合,治疗复发/难治性DLBCL的5年随访数据显示,总缓解率(ORR)达到57.5%,完全缓解率(CR)高达41.2%。
13、GDC-0077
药品信息
①药物名称:伊纳沃利昔布(GDC-0077,Inavolisib,Itovebi)。
②研发公司:罗氏。
③治疗靶点:PIK3CA、HR。
④适应证:局部晚期或转移性乳腺癌。
药物介绍
伊纳沃利昔布是一种高效选择性抑制剂,2024年10月10日,获美国FDA批准,与哌柏西利+氟维司群联合,用于PIK3CA突变、激素受体(HR)阳性、人类表皮生长因子受体2(HER2)阴性、局部晚期或转移性乳腺癌的成人患者的治疗,这些患者在完成辅助内分泌治疗期间或之后出现复发。
本次获批主要是基于一项3期临床研究的结果,Inavolisib组(接受Inavolisib哌柏西利+氟维司群治疗)的客观缓解率高达58.4%,而安慰剂组仅为25.0%。此外,Inavolisib将患者的中位无进展生存期(PFS)提高近一倍,分别为15.0个月(Inavolisib组) vs 7.3个月(安慰剂组),详见下图。
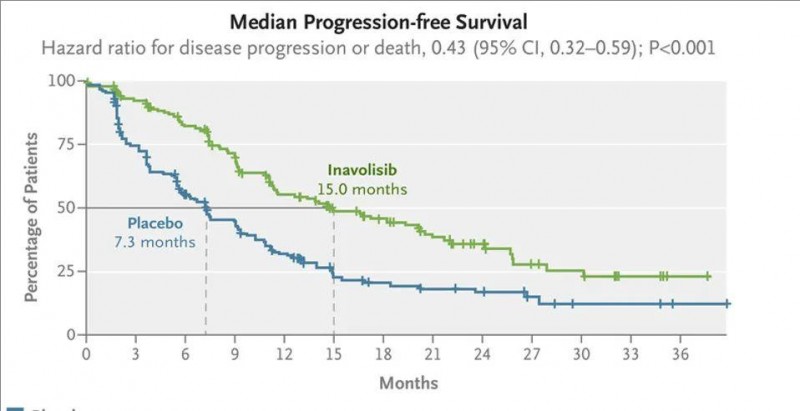
▲图源“N Engl J Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
14、枸橼酸格来雷塞片
药品信息
①药物名称:枸橼酸格来雷塞片(格西拉西,Glecirasib,代号:JAB-21822片)。
②研发公司:加科思。
③治疗靶点:KRAS G12C。
④适应证:胰腺癌、非小细胞肺癌。
药物介绍
枸橼酸格来雷塞片(格西拉西,Glecirasib)近期获中国NMPA授予的突破性疗法认定,用于经一线标准治疗后病情进展且携带KRAS G12C突变的胰腺癌的治疗。2023年 7 月,中国药品监督管理局药品审评中心(CDE)批准了该药的一项关键性试验,它也成为了全球首个KRAS G12C 突变胰腺癌注册的临床研究。
此前的首次人体1/2 期临床研究(NCT05009329)数据显示,在49例可评估疗效的KRAS G12C突变晚期实体瘤(包括胰腺癌、非小细胞肺癌)患者中,总体缓解率(ORR)达到40.8%,疾病控制率(DCR)更是高达91.8%。
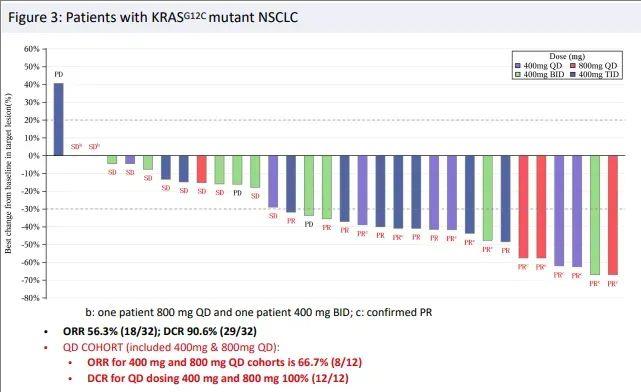
好消息是,目前JAB21822的临床试验正在进行中,主要针对KRAS G12c突变的非小细胞肺癌患者,感兴趣的病友可将治疗经历、近期病理结果等,提交至医学部,了解详细的入排标准。
15、伊匹木单抗注射液
药品信息
①药物名称:伊匹木单抗注射液(Ipilimumab,MDX-010,BMS-734016)。
②研发公司:百时美施贵宝。
③适应证:MSI-H/dMMR表型的结直肠癌。
药物介绍
伊匹木单抗注射液是一种全人类单克隆抗体IgG1κ,可阻断 T 细胞上的抑制性受体细胞毒性 T 淋巴细胞抗原4(CTLA-4)。2024年3月27日,伊匹木单抗联合纳武利尤单抗被中国NMPA纳入优先审评,用于不可切除或转移性微卫星高度不稳定性(MSI-H)、错配修复缺陷型(dMMR)结直肠癌的一线治疗。根据百时美施贵宝公司公布的CheckMate-8HW临床数据显示,伊匹木单抗联合纳武利尤单抗,一线治疗MSI-H/dMMR表型的结直肠癌,将疾病进展或死亡风险降低了79%!
16、纳武利尤单抗注射液
药品信息
①药物名称:纳武利尤单抗(nivolumab,Opdivo,欧狄沃®)。
②研发公司:百时美施贵宝。
③治疗靶点:PD-1。
④适应证:不可切除或转移性尿路上皮癌。
药物介绍
纳武利尤单抗(Opdivo)是一种PD-1(程序性死亡受体-1)阻断抗体,于2024年3月6日,获美国FDA批准,与吉西他滨和顺铂联用,作为不可切除或转移性尿路上皮癌成人患者的一线治疗。值得一提的是,它也成为了全球首个“O+Y”[即纳武利尤单抗(NIVO,Opdivo)+伊匹木单抗(IPI,Yervoy)]双免疫抗癌疗法!
17、甲磺酸阿帕替尼片
药品信息
①药物名称:甲磺酸阿帕替尼片。
②研发公司:恒瑞医药。
③治疗靶点:VEGF、BRCA。
④适应证:晚期胃癌或胃食管结合部腺癌、HER2阴性乳腺癌。
药物介绍
甲磺酸阿帕替尼是我国自研的一款抗癌新药,于 2014 年 10 月 17 日,获中国国家药监局正式批准上市,用于晚期胃癌或胃食管结合部腺癌的三线及三线以上治疗。2024年4月19日,甲磺酸阿帕替尼片+氟唑帕利胶囊的联合疗法,被中国CDE拟纳入优先审评,用于伴有胚系BRCA突变(gBRCAm)的HER2阴性乳腺癌的治疗。
18、氟唑帕利胶囊
药品信息
①药物名称:氟唑帕利胶囊。
②研发公司:恒瑞医药。
③治疗靶点:gBRCAm。
④适应证:HER2阴性乳腺癌、卵巢癌、输卵管癌、原发性腹膜癌。
药物介绍
氟唑帕利胶囊是一款口服的PARP抑制剂,同时也是首个国产获批的PARP试剂。近期该药的药品上市许可申请,获中国NMPA首例,并被纳入优先审评品种公示名单,与甲磺酸阿帕替尼联合,用于治疗伴gBRCAm(胚系BRCA突变)的HER2阴性乳腺癌的治疗。此前,该药已有三个适应证相继获批,包括卵巢癌、输卵管癌、原发性腹膜癌。
19、Elranatamab注射液(埃纳妥单抗)
药品信息
①药物名称:埃纳妥单抗(Elranatamab注射液,Elrexfio)。
②研发公司:辉瑞。
③治疗靶点:BCMA。
④适应证:多发性骨髓瘤。
药物介绍
埃纳妥单抗是一种双特异性 B 细胞成熟抗原 (BCMA)靶向的 CD3 T 细胞接合剂,旨在靶向在肿瘤细胞上高表达的T 细胞表面的CD3、BCMA。2023年8月14日,获美国FDA加速批准,用于先前接受过至少四种治疗的难治性或复发性多发性骨髓瘤的治疗。
本次获批主要是基于一项MagnetisMM-3的2期临床研究(NCT04649359)的惊艳数据,在队列A123例未接受过 BCMA 定向治疗的多发性骨髓瘤患者中,总体缓解率 (ORR)高达57.7%,其中完全缓解率(CR)达到25.8%!这也意味着,经多线治疗失败且陷入绝境的患者,在接受埃纳妥单抗治疗后治疗后,超半数患者肿瘤缩小>30%;此外,还有1/4的幸运患者靶病灶奇迹般全部消失!
20、呋喹替尼胶囊
药品信息
①药物名称:呋喹替尼胶囊(爱优特®)。
②研发公司:和记黄埔医药。
③适应证:转移性结直肠癌。
药物介绍
呋喹替尼胶囊(爱优特®)是一款新型、高选择性小分子VEGFR1、2及3抑制剂,2018年11月25日,正式在中国获批上市,用于转移性结直肠癌(mCRC)的治疗。
III期FRESCO临床研究结果显示,接受呋喹替尼胶囊治疗的转移性结直肠癌患者,其中位总生存期(mOS)显著延长,分别为9.3个月(呋喹替尼组) vs 2.7个月(安慰剂组);中位无进展生存期(mPFS)从1.8个月(安慰剂组)延长至3.7个月(呋喹替尼组),疾病复发风险足足降低74%!
21、信迪利单抗注射液
药品信息
①药物名称:信迪利单抗注射液(Sintilimab,达伯舒®)。
②研发公司:信达生物。
③治疗靶点:PD-1。
④适应证:转移性或局部晚期食管或胃食管(GEJ)癌。
药物介绍
信迪利单抗注射液是一款完全人源化IgG4单克隆抗体,可与PD-1(程序性死亡蛋白1)结合。早在2022年6月24日,就已获中国NMPA批准,与铂类和氟嘧啶类化疗药物联合,用于转移性或局部晚期食管或胃食管(GEJ)癌的一线治疗。2024年3月12日,新适应症申请被纳入优先审评,用于晚期不可切除或转移性pMMR(错配修复功能完整)、微卫星高度不稳定性(MSI-H)子宫内膜癌的治疗,患者既往经系统性抗肿瘤治疗后病情进展,且不适合进行根治性放疗/根治性手术。
信迪利单抗注射液的Ⅱ期临床试验结果显示,既往接受过铂类化疗后病情进展的子宫内膜癌患者,在接受信迪利单抗治疗后,客观缓解率(ORR)达到73.9%(95% CI,51.6~89.8);疾病控制率(DCR)更是高达91.3%(95% CI,72.0 ~98.9),12个月的无进展生存(PFS)率达到57.1%,其中4例患者更是幸运地获得了完全缓解(CR)。
22、盐酸安罗替尼胶囊
药品信息
①药物名称:盐酸安罗替尼胶囊。
②研发公司:正大天晴。
③适应证:子宫内膜癌。
药物介绍
盐酸安罗替尼胶囊是一款新型小分子多靶点的酪氨酸激酶抑制剂,2024年1月,安罗替尼胶囊联合TQB2450注射液的上市申请,被中国CDE纳入优先审评,用于非DNA错配修复缺陷(非dMMR)获非微卫星高度不稳定(非MSI-H)的复发性或转移性子宫内膜癌的治疗,患者既往接受过一、二线化疗方案治疗失败或不能耐受治疗。
2022年欧洲肿瘤内科学会(ESMO)大会上,公布的2期临床研究结果显示,安罗替尼联合贝莫苏拜单抗治疗晚期、复发或转移性子宫内膜癌,其疾病控制率(DCR)高达76.7%,客观缓解率(ORR)达到33.3%,中位无进展生存期(PFS)达6.6个月。
23、己二酸他雷替尼胶囊
药品信息
①药物名称:己二酸他雷替尼胶囊(他雷替尼,Talectrectinib,Taletrectinib Adipate Capsules,DS-6051b,AB-106)。
②研发公司:葆元生物。
③治疗靶点:NTRK、ROS1。
④适应证:非小细胞肺癌。
药物介绍
己二酸他雷替尼胶囊是一款新型ROS1和NTRK双靶点小分子抑制剂,可穿过血脑屏障。近期该药的第2个新药申请(NDA)已获中国NMPA首例,用于ROS1阳性非小细胞肺癌(NSCLC)的一线治疗。
该药的2期TRUST-I临床试验(NCT04395677)显示,在非小细胞肺癌肺癌初治患者中响应良好!客观缓解率(ORR)高达92.5%,疾病控制率(DCR)更是高达95.5%!这也意味着92.5%的患者在接受他雷替尼治疗后,病灶显著缩小甚至消失!
24、Belzutifan片
药品信息
①药物名称:Belzutifan片(贝组替凡,PT2977)。
②研发公司:默沙东。
③适应证:肾细胞癌。
药物介绍
Belzutifan片是一款新型强效、选择性的HIF-2α抑制剂,2024年11月21日,该药的上市申请已获中国NMPA批准,此前该药已被NMPA纳入优先审评,针对中枢神经系统(CNS)血管母细胞瘤、VHL病相关肾细胞癌(RCC)、胰腺神经内分泌肿瘤(pNET)。
25、塔奎妥单抗注射液
药品信息
①药物名称:塔奎妥单抗注射液(Talquetamab)。
②研发公司:强生制药。
③适应证:复发或难治性多发性骨髓瘤
药物介绍
塔奎妥单抗注射液(Talquetamab)是一款“first-in-class”双特异性T细胞结合抗体,可结合T细胞表面的GPRC5D(G蛋白偶联受体家族C组5成员D)、CD3受体。2024年2月4日,该药被中国CDE纳入优先审评,用于既往接受过至少三种治疗的复发或难治性多发性骨髓瘤成年患者的治疗。此前(2023年8月)该药已获美国FDA的加上批准,用于成人复发性或难治性多发性骨髓瘤的治疗。
本次获FDA批准,主要是基于1/2期MonumenTAL-1的临床研究结果,在长达的18.8个月的中位随访中,接受塔奎妥单抗治疗的患者,74.1%实现缓解,33.6%的患者达到了完全缓解(CR)或更好。
26、注射用德曲妥珠单抗
药品信息
①药物名称:注射用德曲妥珠单抗(T-DXd、DS-8201、Trastuzumab deruxtecan、优赫得®、Enhertu®)。
②研发公司:第一三共(中国)。
③治疗靶点:HER2。
④适应证:HER2低表达乳腺癌、转移性或不可切除的HER2阳性乳腺癌、HER2阳性胃或胃食管结合部腺癌、HER2突变的非小细胞肺癌。
药物介绍
德曲妥珠单抗(T-DXd)是一款靶向HER2的第三代ADC药物,可同时杀伤目标及邻近的肿瘤细胞,该药已在我国获批用于成人HER2低表达乳腺癌、转移性或不可切除的HER2阳性乳腺癌、HER2阳性胃或胃食管结合部腺癌、HER2突变的非小细胞肺癌(NSCLC)的治疗。
值得一提的是,德曲妥珠单抗是首个针对HER2突变转移性非小细胞肺癌(NSCLC)的HER2靶向疗法,同时也是首个获批治疗HER2低转移性乳腺癌的疗法,以及首个不限癌种适应证的ADC药物!填补了我国在ADC治疗领域的空白,具有里程碑式的意义!
27、TQB2450注射液
药品信息
①药物名称:贝莫苏拜单抗(TQB2450注射液)。
②研发公司:正大天晴。
③治疗靶点:PD-L1。
④适应证:。
药物介绍
贝莫苏拜单抗(TQB2450注射液)是一款全新序列的全人源化抗PD-L1单克隆抗体。2023年1月,该药的上市申请获得中国CDE受理,与安罗替尼联合,用于小细胞肺癌的一线治疗。2024年,该药的另一适应证,被国家药品监督管理局药品审评中心 (CDE) 纳入优先审评,与盐酸安罗替尼胶囊联合,用于复发性或转移性子宫内膜癌的治疗。
盐酸安罗替尼胶囊是一款新型小分子多靶点的酪氨酸激酶抑制剂,2024年1月,安罗替尼胶囊联合TQB2450注射液的上市申请,被中国CDE纳入优先审评,用于非DNA错配修复缺陷(非dMMR)获非微卫星高度不稳定(非MSI-H)的复发性或转移性子宫内膜癌的治疗,患者既往接受过一、二线化疗方案治疗失败或不能耐受治疗。
小编寄语
这些新药的加速审评和上市,无疑为广大癌症患者带来了新的希望和更有效的治疗选择。我们也期待这些新药能够顺利通过评审,尽快应用于临床实践,让更多的癌症患者有药可医!
好消息是,目前我国有多款在研药物已相继开展临床试验,这也意味着中国患者将有免费获得最新抗癌药物治疗的机会。同时,“方舟援助计划”也可为患者提供上市及未上市新药的免费治疗机会。对现有治疗方案不满意的癌友,可将近期影像及病理检查结果、治疗经历等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Fang W,et al.Sacituzumab tirumotecan (SKB264/MK-2870) in combination with KL-A167 (anti-PD-L1) as first-line treatment for patients with advanced NSCLC from the phase II OptiTROP-Lung01 study[J]. 2024.
https://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.8502
[2]Ruan D,et al.Preliminary results of phase I/II study to textareauate safety and efficacy of combination pucotenlimab with epidermal growth factor receptor-ADC (EGFR-ADC) MRG003 in patients with EGFR positive solid tumors[J]. 2024.
https://meetings.asco.org/abstracts-presentations/234882
[3]Li Z,et al.SHR-A1811 (antibody-drug conjugate) in advanced HER2-mutant non-small cell lung cancer: a multicenter, open-label, phase 1/2 study. Signal Transduct Target Ther. 2024 Jul 15;9(1):182.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11247081/
[4]Yang JC,et al.Safety, Efficacy, and Pharmacokinetics of Almonertinib (HS-10296) in Pretreated Patients With EGFR-Mutated Advanced NSCLC: A Multicenter, Open-label, Phase 1 Trial. J Thorac Oncol. 2020 Dec;15(12):1907-1918.
https://www.jto.org/article/S1556-0864(20)30714-0/fulltext
[5]Hong Z,et al.The Safety and Efficacy of p CAR-19B, a Scfv Humanlized CD19-Directed CAR-T for Patients with Relapsed/Refactory (R/R) CD19+ B-ALL[J]. Blood, 2022, 140(Supplement 1): 4625-4626.
https://ashpublications.org/blood/article/140/Supplement+1/4625/491174/The-Safety-and-Efficacy-of-p-CAR-19B-a-Scfv
[6]Turner N C,et al.Inavolisib-based Therapy in PIK3CA-Mutated Advanced Breast Cancer[J]. New England Journal of Medicine, 2024, 391(17): 1584-1596.
https://www.nejm.org/doi/full/10.1056/NEJMoa2404625