患者必须知道的四大新型细胞免疫治疗法,完全缓解率超74%
恶性肿瘤作为严重威胁人类健康与生命的主要疾病之一,其发病率和死亡率呈现出逐年攀升的态势。据世界卫生组织(WHO)专家预测,2020年全球人口80亿,癌症新发病例数量高达2000万。长期以来,手术、放疗以及化疗始终是肿瘤治疗的三大常规手段,然而对于众多肿瘤而言,其治疗效果仍不尽人意。
不过,随着生物科技的迅猛发展以及肿瘤治疗理念的转变,免疫治疗已然成为肿瘤综合治疗的第四种模式,并且备受瞩目。尽管在现阶段,免疫治疗尚无法完全取代传统治疗手段,但在提升手术、放化疗疗效,延长患者生存期以及改善生存质量等方面,已获得越来越广泛的认可。
基于此,近期“中国抗癌协会肿瘤生物治疗专业委员会”正式颁布了《恶性肿瘤免疫治疗技术应用指南》,进一步肯定了免疫治疗,尤其是过继性免疫细胞疗法在肿瘤治疗中的关键地位,同时明确了其应用范围、操作流程、疗效评估等相关内容。接下来,小编将依据指南重点内容,并结合最新研究进展,为癌友们简要介绍指南着重提及的四大免疫细胞疗法,以供癌友们参考!

▲截图源自“CJCO”
CAR-T细胞疗法
何谓CAR-T细胞疗法
CAR-T细胞疗法即嵌合抗原受体T细胞疗法,是利用基因转导技术,在T细胞上安装一个名为“CAR”的“导航头”,改造后的T细胞可以精准识别肿瘤抗原,并释放针对肿瘤细胞的细胞毒性,最终达到即时和长效的抗癌作用。
CAR-T疗法的治疗过程
1、淋巴细胞采集:从患者体内采集血液,并分离提取T细胞。
2、制备CAR-T细胞:在实验室中,对采集好的T细胞进行加工,在其表面按照“CAR”导航头,使其精准识别并杀伤特定的癌细胞,制备过程通常需要10天~数周左右。
3、预处理:在回输CAR-T细胞前,患者需要进行淋巴细胞清除治疗,常用的预处理方案包括环磷酰胺+氟达拉滨联合治疗。
4、CAR-T细胞输注:一般预处理后48h,通过静脉回输的方式,输注CAR-T细胞,最长不宜超过7天。
5、疗效评估:推荐CAR-T细胞输注后第28天或血象恢复后,完成骨髓细胞学检测进行疗效评估。伴髓外病变者,建议在CAR-T治疗28天同时评估髓外病变,MRI、CT或X线片均可作为评估手段,3个月后可考虑PET-CT评估(注:具体复诊时间需遵医嘱)。

▲图源“Frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
国内外已获批的CAR-T产品
截至目前,全球范围内共有12款获批的CAR-T产品,包括美国7款、中国5款(详见下表)。
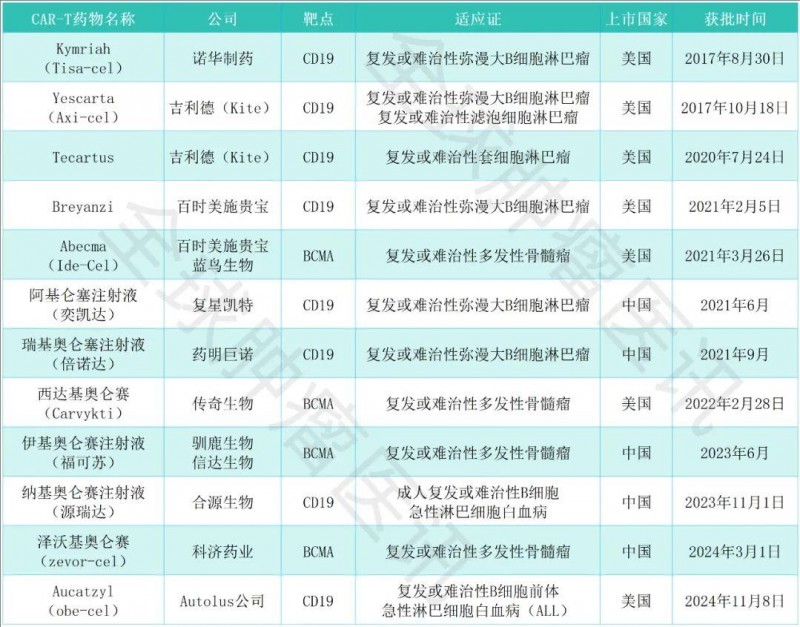
▲全球肿瘤医生网医学部整理汇总
CAR-T适用人群的一般要求
1、预计生存期>12周。
2、无活动性感染。
3、免疫组织化学或流式细胞术,检测瘤细胞相应靶点阳性。
4、卡氏(KPS)评分250分,或者ECOG体力状态评分(ECOG PS)<2分。
5、具有良好的心、肺、肝脏功能:
①左心室射血分数(LVEF)>50%;
②谷丙转氨酶(ALT)、谷草转氨酶(AST)<正常3倍;
③胆红素<2.0 mg/dL;
④室内空气患者血氧饱和度>92%。
CAR-T细胞适用的肿瘤类型
1、血液肿瘤
众所周知,CAR-T疗法在血液系统恶性肿瘤中的治疗潜力有目共睹,目前获批的12款产品无一例外都是用于血液肿瘤的治疗。根据《恶性肿瘤免疫治疗技术应用指南》,目前CAR-T细胞在血液肿瘤治疗领域,主要用于治疗弥漫性大B细胞淋巴瘤、滤泡性淋巴瘤和边缘区淋巴瘤、套细胞淋巴瘤、慢性淋巴细胞白血病、霍奇金淋巴瘤、T细胞淋巴瘤等。
▼CAR-T治疗实体瘤的热门靶点
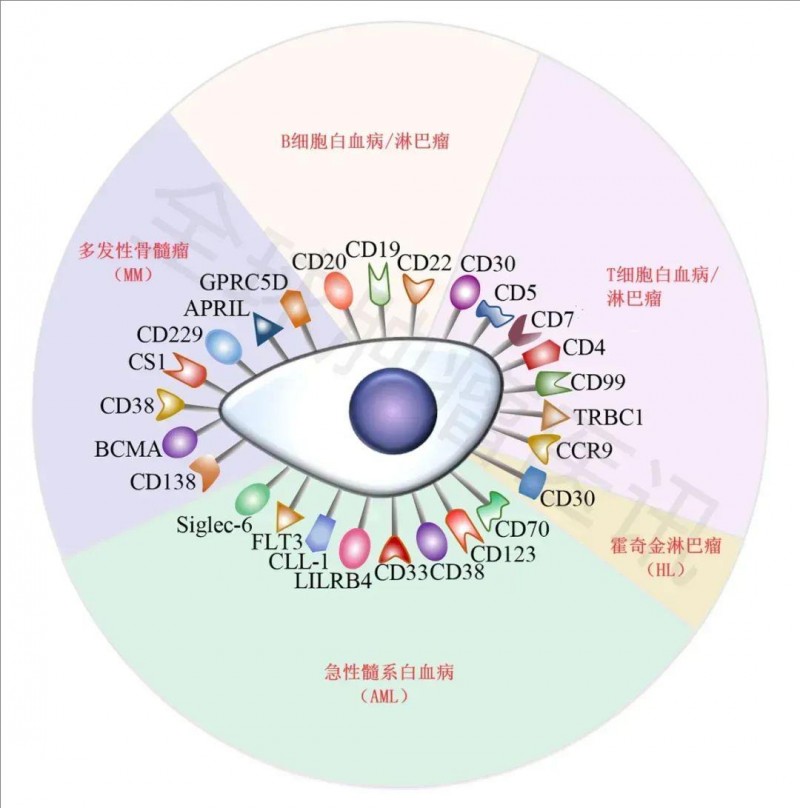
2、实体肿瘤
随着更多可改善CAR-T疗法的因素被确定,越来越多的临床研究开始将CAR-T疗法用于各种实体瘤肿瘤的治疗,CAR-T在实体瘤中的疗效,主要需要考虑靶分子(肿瘤抗原)、肿瘤微环境、影响T细胞持久性和归巢的细胞内在和外在因素等。目前,CAR-T细胞治疗在实体瘤中的主要治疗靶点及癌种如下:
①Claudin18.2(CLDN18.2):CLDN18.2在胃癌、胰腺癌等肿瘤中呈高表达,是治疗胃癌、胰腺癌等实体瘤的潜在靶点。目前,包括胃癌、胰腺癌在内的20多款靶向CLDN18.2的细胞治疗产品,处于临床前或早期临床研究阶段,并取得了不俗的疗效。
②间皮素(mesothelin,MSLN):间皮素是一种含糖磷脂酰肌醇(GPI)的细胞表面糖蛋白,通过GPI 锚定在细胞膜表面。以MSLN 为靶点的实体瘤的CAR-T 细胞治疗,目前约有20 项进入临床研究阶段,主要集中在Ⅰ/Ⅱ期,适应证包括间皮瘤、胰腺癌、卵巢癌、胆管癌、肺癌、乳腺癌等。
③鸟苷酸环化酶C(GCC/GUCY2C):GUCY2C在原发性结直肠癌细胞呈稳定表达,而在转移性结直肠癌细胞中异常高表达,被认为是转移性结直肠癌特异性标志分子之一,目前约有10项以GUCY2C为靶点的实体瘤CAR-T细胞进入临床研究阶段,主要针对结直肠癌的治疗。
④GPC3:GPC3(即磷脂酰肌醇蛋白聚糖3)在调控细胞生长和分化方面起重要作用,与肝癌的发生、发展密切相关。目前,已有多个靶向GPC3细胞治疗产品在临床前或早期临床研究阶段,主要用于肝细胞癌治疗,其他包括肺癌、胆管癌、梅克尔(Merkel)细胞癌、横纹肌肉瘤、肾母细胞癌等。
⑤EpCAM:EpCAM(即上皮细胞黏附分子)是一种糖基化Ⅰ型跨膜糖蛋白,目前在临床阶段的适应证主要针对胃癌、结直肠癌等晚期消化系统肿瘤
CAR-T最新研究进展:急性髓细胞白血病完全缓解率高达74.5%
近期我国公布了一项“应用CLL1 CAR-T细胞,治疗急性髓细胞白血病”的惊艳临床研究数据,为急性髓细胞白血病尤其是伴髓外浸润病灶(EMD)、预后较差的患者带来了一线曙光!
该研究共入组47例急性髓细胞白血病(AML)患者,包括27例单纯骨髓浸润、20例骨髓浸润及髓外浸润者,既往接受过平均4线(范围:2~13)治疗,但效果不理想,遂入组接受CLL1 CAR-T细胞回输治疗。
结果显示:全部入组患者中,完全缓解(CR)率高达74.5%(35/47),中位无进展生存期(PFS)长达282天,中位总生存期(OS)更是长达466天!
值得一提的是,其中1为44岁髓外代谢肿瘤体积(MTV)达到30.35cm的女性患者,在CAR-T治疗35天后,奇迹般达到完全代谢反应(CMR),髓外肿瘤灶几乎被根除(详见下图)。
▼该患者在CLL1 CAR-T细胞回输前后的PET-CT对比图
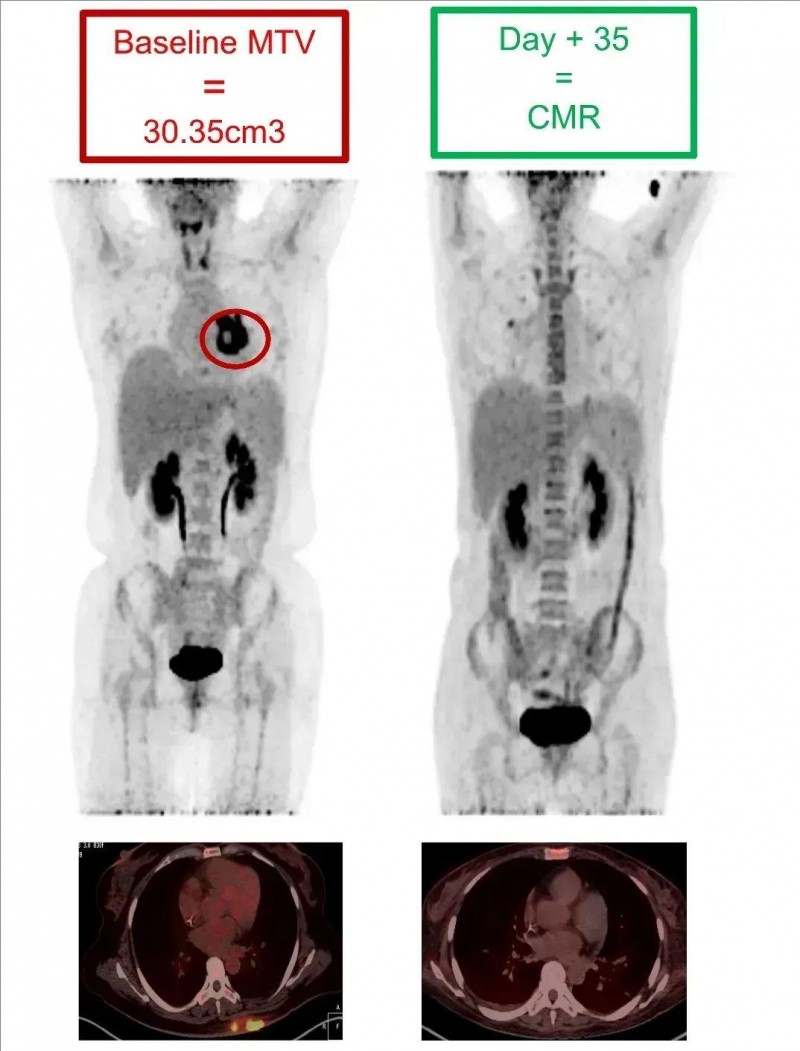
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:红色圆圈表示——最具代表性的髓外病变部位。
TCR-T细胞疗法
何谓TCR-T细胞疗法
“TCR-T细胞”即“T细胞受体工程化T细胞疗法”是通过基因工程技术,将抗原特异性TCR基因序列(α及β链),转移到T细胞中,与CAR-T类似,TCR-T细胞可以通过表达TCR来识别MHC复合体呈递的肿瘤抗原,并释放针对肿瘤细胞的细胞毒性。
在实体瘤中具有肿瘤趋化性和靶向性的独特优势,现全球有200多项主要针对实体瘤的TCR-T细胞临床试验,主要用于治疗恶性黑色素瘤、肉瘤、肺癌、消化道恶性肿瘤等。
做过基因检测的癌友可立即拿出报告,自行查看是否存在上述突变,一旦发现存在上述突变,可立即联系医学部,初步评估是否有机会接受CAR-T、TCR-T、TIL或NK疗法等国内外新型抗癌技术的帮助。看不懂检测报告的癌友,也可联系全球肿瘤医生网医学部,详细解读检测报告。
TCR-T细胞疗法的治疗过程
1、淋巴细胞分离:与CAR-T细胞类似,也需要从患者体内采集血液,并分离提取T细胞。
2、化疗预处理:常用预处理方案为氟达拉滨注射液+环磷酰胺注射液。
3、TCR-T 细胞输注:回输前需再次评估患者临床状态,体温、心率、血压、氧合情况、有无活动性感染和严重器官功能不全等,并在回输过程中严密监测患者生命体征,必要时使用托珠单抗注射液等,处理相关副作用。
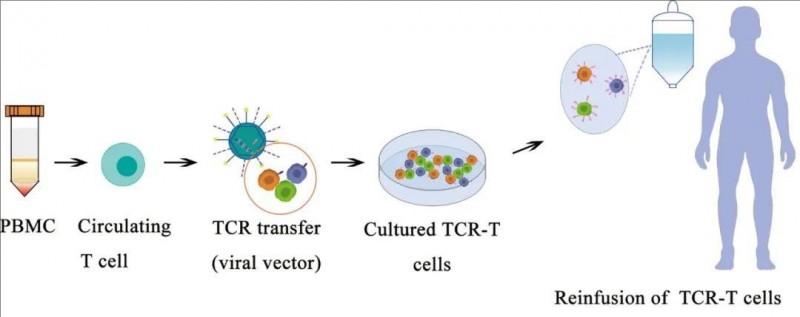
▲图源“Frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
国内外已获批的TCR-T细胞产品
2024年8月2日,全球首款实体瘤TCR-T疗法——Afami-cel(TECELRA®),获美国食品药品监督管理局(FDA)批准,用于晚期滑膜肉瘤的治疗,是十多年来首个针对滑膜肉瘤患者的新治疗选择!随着Afami-cel的获批,TCR-T疗法也逐渐成为了应用过继性免疫细胞疗法治疗癌症的前沿技术!
TCR-T细胞疗法适用人群的一般要求
1、主要为18岁以上成年人,最大年龄一般不超过80岁。
2、明确诊断为恶性肿瘤且经二线方案治疗失败或不可耐受的患者。
3、ECOG评分为0~1分的患者。
TCR-T细胞疗法适用的肿瘤类型
目前,TCR-T细胞治疗的靶点主要针对肿瘤-睾丸抗原家族,如NY-ESO-1、MAGE-A3、MAGE-A4等,此外还包括CEA抗原等(详见下图)。临床主要治疗的癌种范围包括恶性黑色素瘤、非小细胞肺癌、卵巢癌、头颈癌、晚期宫颈癌、结直肠癌、乳腺癌等。
▼早期TCR-T产品覆盖的靶点及肿瘤适应证
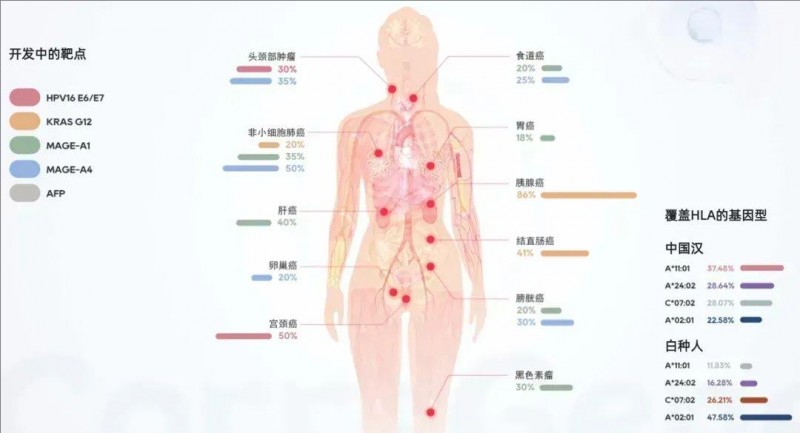
▲图源“CorreGene”,版权归作者所有,如无意中侵犯了知识产权,请联系我们删除
TCR-T疗法的最新研究进展:晚期乙肝相关肝癌肿瘤缩小超70%
《临床与分子肝病杂志》近期报道了一个“晚期乙肝相关肝癌患者,经单剂SCG101 TCR-T治疗后,肿瘤显著缩小超70%,且乙肝表面抗原急剧下降”的案例。
该患者为一位54岁IIb期]乙肝相关肝癌(HBV-HCC)患者,基因型为HLA-A*02:01,肝功能评估分类为Child-PughA级,东部肿瘤协作组体能状态0。既往接受过动脉化疗栓塞术+肿瘤和肝段VIII切除术+索拉非尼及恩替卡韦治疗,但效果均不理想。更遗憾的是,该患者此时已无法耐受手术治疗了,遂入组接受淋巴细胞清除+SCG101回输治疗。结果显示:
1、肿瘤灶显著缩小:该患者在治疗前,右叶可见两个靶病灶以及多个结节,直径分别为21mm、38mm(详见下图,上排)。在回输SCG101后第28天,肿瘤大面积坏死(详见下图,第二排),靶病灶分别减少74.5%、47.5%,并最终达到部分缓解(PR),目标病变显著缩小70%以上。
▼该患者SCG101治疗前后多相CT扫描对比
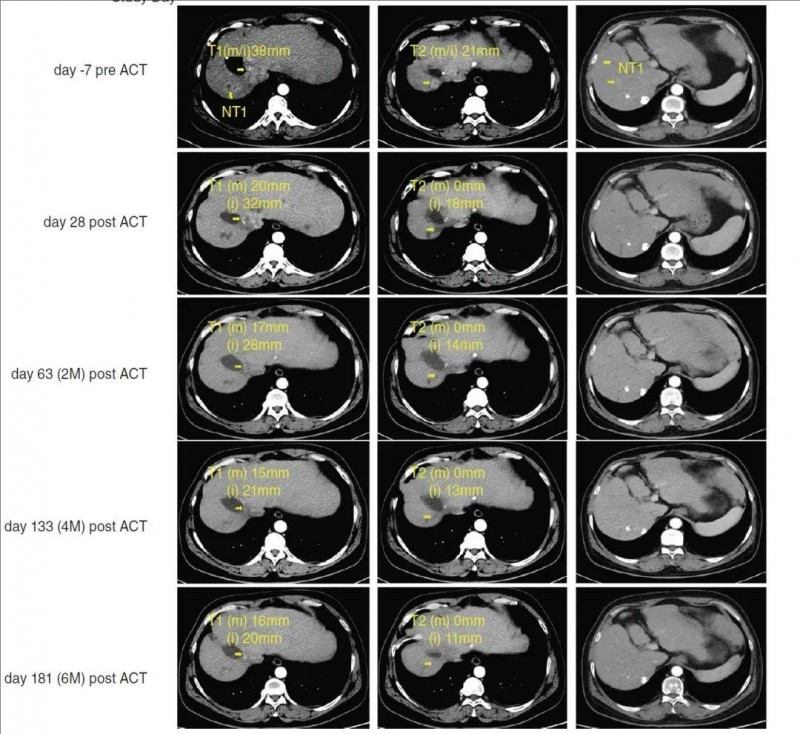
▲图源“Clin Mol Hepatol ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:
①本图显示该患者在治疗前第-7天,以及SCG101治疗后第28、63、133、181天,通过多相CT扫描分析肿瘤负荷。
②“黄色”表示:mRECIST(m)或iRECIST(i)中,靶(T)病变1号和2号的大小,以及非靶(NT)病变的位置。
2、乙肝表面抗原(HBsAg)大幅下降:血清乙肝表面抗原(HBsAg)在细胞移植1周内,从557.96IU/ml,骤降至1.3IU/ml,与基线相比最大降幅达3.84log10~0.08IU/mL,且该水平维持超6个月(详见下图)。并最终在回输SCG10173天后,肝活检中表达HBsAg的肝细胞无法检测到。
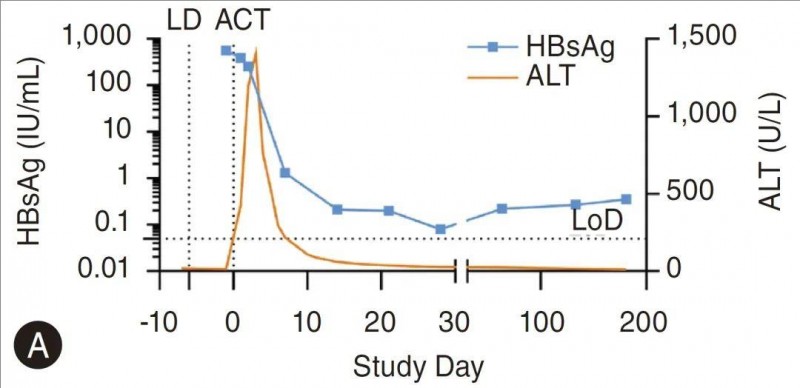
▲图源“Clin Mol Hepatol ”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:
①“右轴,橙色线”——诊断ELISA的检测下限(LoD)为0.05IU/mL,再次绘制图6B中的ALT值;
②“左轴,蓝色方块”——在指定时间点测量血清中的HBsAg;
③“虚线”——表示过继细胞转移(ACT)时间点。
TIL细胞疗法
何谓TIL细胞疗法
TIL疗法即肿瘤浸润淋巴细胞疗法,是从癌症患者自身的肿瘤活检组织中,采集出肿瘤细胞周围浸润的淋巴细胞,在体外进行扩增和培养后,再回输到患者体内的一种过继性免疫细胞疗法。
TIL细胞是埋伏在肿瘤周围的“抗癌大杀器”,具有识别和杀死肿瘤细胞的能力。然而,肿瘤中的TIL数量有限,且其功能通常受肿瘤或肿瘤微环境抑制,无法控制肿瘤生长。因此,需要通过体外培养扩增到一定的庞大数量后,当扩增后的这些TIL细胞,重新输入患者体内时,就可以发挥强大的抗肿瘤作用,让癌细胞无处遁形。
TIL细胞疗法的治疗过程
与CAR-T及TCR-T不同,TIL细胞通常从患者切除的肿瘤材料中收集;然后,在体外富集和扩增新抗原特异性TIL,并作为治疗剂输送回患者体内(详见下图)。
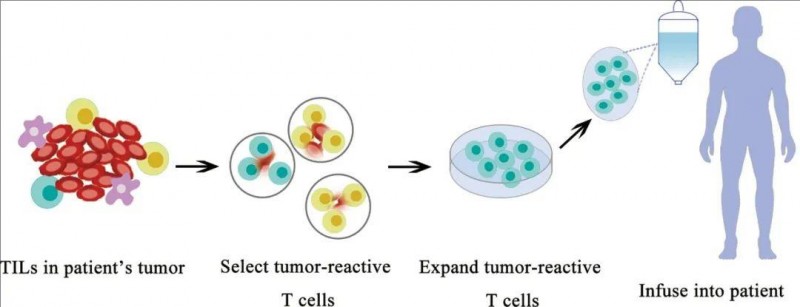
▲图源“frontiers”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
据统计,肿瘤组织中分离出的免疫细胞,>60%可识别肿瘤;而血液中分离出的免疫细胞,不足0.5%。然而,遗憾的是,患者手术切除的肿瘤组织,除了一小部分做成病理蜡块,用于病理诊断外,其余大部分组织通常会作为医疗垃圾直接丢弃掉,这无疑白白浪费了深藏在患者体内的这些宝贵抗癌资源。此外,TIL细胞数量会随肿瘤进展而逐渐降低,且术后接受辅助性放化疗也会影响TIL细胞的功能及活性。
因此,建议患者珍惜有且可能仅有一次的宝贵抗癌机会!在术前争得主治医生的同意后,将新鲜的标本组织留存,交由专业机构进行TIL细胞分离培养及冻存,以备不时之需。如果您还想了解TIL细胞制备、冻存或治疗的更多内容,可咨询医学部,了解具体的流程。
国内外已获批的TIL产品
2024年2月16日,全球首款TIL细胞疗法——Lifileucel(Amtagvi®,LN-144)获美国FDA批准上市,用于既往接受过PD-1治疗的不可切除或转移性黑色素瘤的治疗,2期临床试验结果显示,Lifileucel的疾病控制率(DCR)达到惊人的77.8%!这意味着近80%的极晚期黑色素瘤患者,在接受此款TIL细胞治疗后,出现了不同程度的肿瘤缩小或控制稳定!
TIL细胞疗法适用的肿瘤类型
TIL细胞疗法是治疗实体瘤的“抗癌大杀器”,可用于治疗黑色素瘤、宫颈癌、结直肠癌、非小细胞肺癌、头颈癌、卵巢癌、胆管癌等多款实体瘤。
多项研究显示,使用TIL疗法可导致多种癌症的客观肿瘤消退,既可用于癌症早期的术后辅助治疗收到,帮助消灭残留的癌细胞、预防肿瘤复发;又可作为癌症晚期的末线补救治疗,以尽可能延长患者生存期、提高生活质量。
TIL疗法的最新研究进展,晚期宫颈癌治疗28天即达部分缓解,转移灶明显消退
《莫尔生物医学》近期报道了一个“应用GT101治疗晚期复发及转移性宫颈癌,获得部分缓解(PR)”的惊艳案例。
该患者为一位晚期复发及转移性宫颈癌患者,治疗前计算机断层扫描显示,左下腹部(图a,红色箭头)、左侧锁骨上淋巴结(图c,绿色箭头)均存在皮下转移(详见下图)。
在回输GT101 TILs细胞28天后,锁骨上淋巴结萎缩(图b,黄色箭头)、左下腹部皮下转移(图d,蓝色箭头)与左侧一致(详见下图)。
▼该患者在GT101治疗前后的计算机断层扫描对比
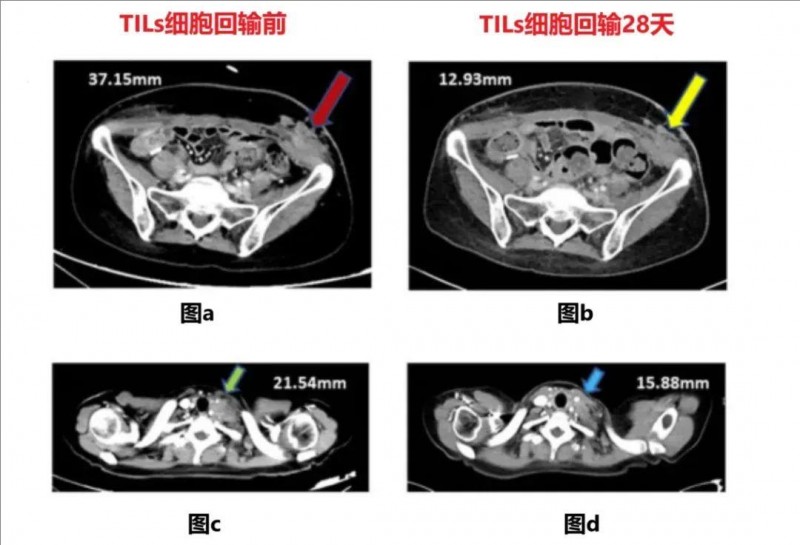
▲图源“Mol Biomed”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
NK细胞疗法
何谓NK细胞疗法
NK细胞即自然杀伤细胞,是人体抗癌和抗病毒感染的“第一道防线”,无需事先致敏,即可通过直接识别表面配体杀死癌细胞,作为机体天然免疫的重要细胞,既可像T细胞一样通过工程化改造后靶向治疗肿瘤,还可进行同种异体来源的NK细胞输注治疗,弥补了T细胞自体来源受限和异体免疫排斥的缺点,具有抗肿瘤范围广、无需激活和抗原识别等优势,在抗肿瘤、抗病毒感染等方面发挥着重要作用!
NK细胞疗法适用的肿瘤类型
同种异体NK细胞已在临床试验中得到了广泛研究,可用于治疗多种血液系统恶性肿瘤(如淋巴瘤等),以及多种实体瘤的治疗,如肺癌、胃癌、结直肠癌、胰腺癌、肝细胞癌(HCC)、乳腺癌、肾细胞癌、卵巢癌、黑色素瘤、神经母细胞瘤等。
▼NK细胞疗法针对的热门靶点
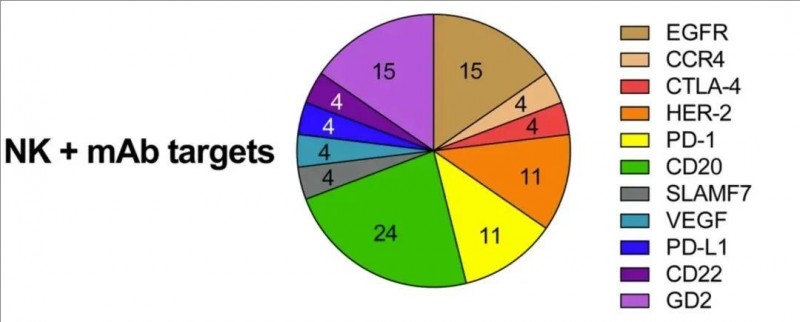
▲图源“BMC”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
NK细胞最新研究进展,非小细胞肺癌无进展生存率提高近1倍
近期一项“应用NK细胞治疗非小细胞肺癌的II期临床研究,将无进展生存率提高了近1倍”!该研究共入组16例晚期(Ⅲa/b期)鳞状细胞肺癌患者,入组接受NK细胞回输治疗。
结果显示:接受自体NK细胞+放化疗组的患者,1年无进展生存率(PFS)高达67%,而对照组(仅接受放化疗)患者仅为33%,显然与对照组相比,接受NK细胞回输治疗将患者的1年PFS率提高了近1倍!
值得一提的是,在18个月后的最后一次随访发现,NK细胞治疗组有1例患者奇迹般地获得完全缓解(CR)。该患者在治疗前,可在纵隔淋巴结及左肺门处减靶病变,尤其在VS处清晰可见。而在放化疗(RCT)后的V1、随机分组18 个月后(V8)的后续检查中,两处病变均不可见(详见下图),故达到完全缓解(CR)。
▼该患者治疗前后的影像图变化
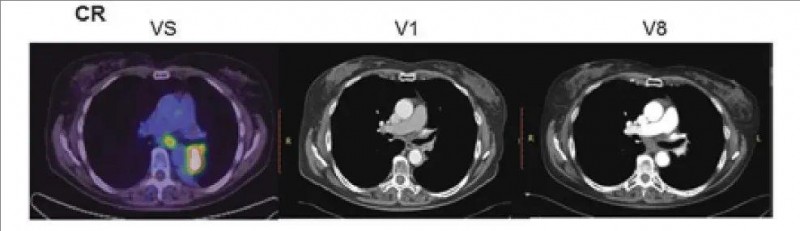
▲图源“AACR”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
癌症治疗一直是困扰世界的难题,传统的手术、放化疗等抗癌方式,易出现复发或转移,因此迫切需要开发新型抗癌手段。随着医学技术的不断发展,癌症逐渐进入精准治疗的时代,以CAR-T、TCR-T、TIL、NK细胞疗法等为代表的免疫细胞疗法,主要通过调动人体的免疫细胞,精准识别并杀灭癌细胞,与此同时对正常细胞组织的损伤较小,颠覆了传统的抗癌模式!
值得欣慰的是,目前这些免疫细胞疗法,都取得了突破性进展,尤其是随着多款细胞疗法的相继获批上市,为肿瘤患者带来了新的曙光!对目前治疗方案不满意,或想寻求CAR-T、TCR-T、TIL、NK疗法等国内外其他抗癌新技术帮助的患者,可将治疗经历、出院小结、近期病理报告等资料,提交至医学部,进行初步评估或申请国内外抗癌专家会诊。
参考资料
[1]Luo C,et al.Progress and prospect of immunotherapy for triple-negative breast cancer[J]. Frontiers in Oncology, 2022, 12: 919072.
https://www.frontiersin.org/journals/oncology/articles/10.3389/fonc.2022.919072/full
[2]Zhao Y,et al.Efficacy and safety of CAR-T therapy targeting CLL1 in patients with extramedullary diseases of acute myeloid leukemia[J]. Journal of Translational Medicine, 2024, 22(1): 888.
https://translationalmedicine.biomedcentral.com/articles/10.1186/s12967-024-05705-7
[3]Wan X,et al.Genetically-modified, redirected T cells target hepatitis B surface antigen-positive hepatocytes and hepatocellular carcinoma lesions in a clinical setting. Clin Mol Hepatol. 2024 Oct;30(4):735-755.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11540345/
[4]Zhao X,et al.T cell receptor repertoire characteristics and therapeutic potential of tumor infiltrating lymphocytes (TILs) derived from linkstatic lymph node in cervical cancer. Mol Biomed. 2024 Nov 4;5(1):51.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11532323/
[5]Multhoff G,et al.Targeted Natural Killer Cell-based Adoptive Immunotherapy for the Treatment of Patients with NSCLC after Radiochemotherapy: A Randomized Phase II Clinical Trial. Clin Cancer Res. 2020 Oct 15;26(20):5368-5379.
https://aacrjournals.org/clincancerres/article/26/20/5368/82812/Targeted-Natural-Killer-Cell-based-Adoptive