编者按:CAR-T,全称是Chimeric Antigen Receptor T-Cell Immunotherapy,嵌合抗原受体T细胞免疫疗法。目前CAR-T在血液疾病和淋巴瘤的治疗上已经取得突破性进展。随着技术的进步,CAR-T成为无进展生存癌症的新希望。
基于血液瘤临床试验已经取得的突破性进展,我们认为CAR-T疗法成为癌症治疗第五大治疗手段是大概率事件。预计美国血液瘤每年潜在市场空间达到480亿美金(按30万美金/人计),国内血液瘤潜在市场规模达到250亿人民币(按10万元/人计)。
CAR-T是一种非常个性化的疗法,产品的供应方式和传统药物有着根本性的区别。因此,实现CAR-T产品的标准化是首要任务,标准化意味着药效可控、风险可控。未来市场必定属于能够将CAR-T细胞特异化,治疗流程精细化、标准化的企业。当下进行粗放式开发的医院或者企业,在未来必定会被淘汰。
CAR-T疗法具有极强的技术属性,可复制性强,与传统新药研发有着明显不同,对于新药研发刚刚起步的中国,存在弯道超车的可能。目前国内开展的CAR-T临床试验数量已经多达19项,仅次于美国,这也是中国首次在新药研发领域走到国际前列。
目前被用于癌症治疗的普通免疫细胞(NK、DC、CIK等),我们认为,未来会逐渐退出临床治疗。但由于这类免疫细胞客观上能够提升人体免疫力,而且均为自体细胞扩增,回输风险较小,有望在养生保健以及辅助治疗领域取得较大市场。
风险提示:对于CAR-T疗法研发企业,风险来源于临床进展不利;对于普通免疫细胞企业,风险来源于监管从严以及医保控费。
☆肿瘤免疫治疗的核心是克服免疫逃逸
1.1免疫编辑理论
肿瘤是机体正常细胞恶变的产物,其特点是不断增殖并在体内转移。因此肿瘤细胞在免疫学上的突出特点是会出现一些在同类正常细胞中看不到的新的抗原标志。现已陆续发现的肿瘤抗原包括肿瘤特异性抗原和肿瘤相关抗原。前者为肿瘤细胞所独有;后者大多指胚胎性抗原,为胚胎组织与肿瘤组织所共有。由于肿瘤抗原的存在,势必被机体免疫系统所识别,并由此激发特异性免疫反应,包括细胞免疫和体液免疫两类。肿瘤的体液免疫主要是抗肿瘤抗体对肿瘤细胞的破坏效应;细胞免疫主要指T淋巴细胞、CIK细胞、NK细胞和巨噬细胞等免疫细胞对肿瘤细胞的杀伤作用。
肿瘤细胞表现为基因突变和致癌基因的过表达,这些突变或异常基因表达的蛋白是免疫细胞赖以识别癌细胞的基础。理论上,免疫细胞可以随时清除不正常的细胞,从而把肿瘤消灭于萌芽状态,也即所谓的“免疫监视”。但免疫监视作用并不能完全避免恶性肿瘤的发生,而且肿瘤一旦产生后,会隨病情的发展,恶性程度逐渐增加,最终发生广泛转移。
2002年,美国肿瘤生物学家R.D. Schreiber提出了“肿瘤免疫编辑”理论。根据该理论,免疫系统不但具有排除肿瘤细胞的能力,同时还具有促进肿瘤生长的作用。癌细胞在机体内发生、发展是一个免疫系统与癌细胞一系列动态复杂的相互作用过程。在这个过程中,免疫系统清除一些肿瘤细胞的同时,也对另一些肿瘤细胞的生物学特性(如肿瘤的抗原性)进行重塑,也即所谓的“免疫编辑”。被免疫辑过的肿瘤细胞恶性程度越来越高,对免疫攻击的抵抗力越来越强,直至最终摧毁机体的免疫系统,造成肿瘤细胞的恶性生长并扩散。
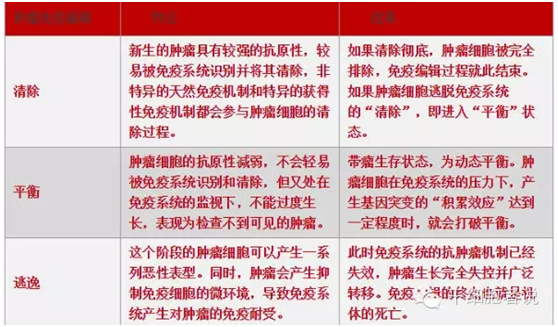
肿瘤免疫编辑理论
1.2传统过继性免疫细胞
癌症免疫疗法(Cancer Immunotherapy)是继手术、化疗、放疗和靶向疗法之后出现的一种新型治疗方法,被称为治疗癌症的“第五大疗法”。它是利用患者自身免疫系统的力量来抵抗癌症。免疫治疗经历了多年的不断发展,近几年,取得了越来越多令人鼓舞的研究成果。2013年,癌症免疫疗法被国际学术期刊《Science》杂志评为年度十大科学突破之首。
肿瘤免疫治疗可以广义地分为非特异性和肿瘤抗原特异性两大类。非特异性的手段包括免疫检验点阻断和非特异地激活免疫细胞;而肿瘤抗原特异性的方法主要是各种各样的肿瘤疫苗和过继免疫细胞疗法。
肿瘤过继免疫疗法是将自身或异体的抗肿瘤效应细胞的前体细胞,在体外采用IL-2、抗CD3单抗、特异性多肽等激活剂进行诱导、激活和扩增,然后回输给肿瘤患者,提高患者抗肿瘤免疫力,以达到治疗和预防复发的目的。常见的有如下几种。LAK细胞,用高浓度IL-2激活病人自体或正常供者的外周血单个核细胞。TIL细胞,从切除的瘤组织或癌性胸腹水中分离淋巴细胞,体外经IL-2诱导激活和扩增。DC-CIK细胞,将DC细胞与CIK细胞混合培养,两者能相互调节而增加细胞因子释放和增强细胞毒性,从而显著提高CIK细胞的增殖能力和杀伤活性,临床治疗效果优于CIK等其它效应细胞。CTL细胞,用特异性多肽抗原体外诱导CTL克隆。
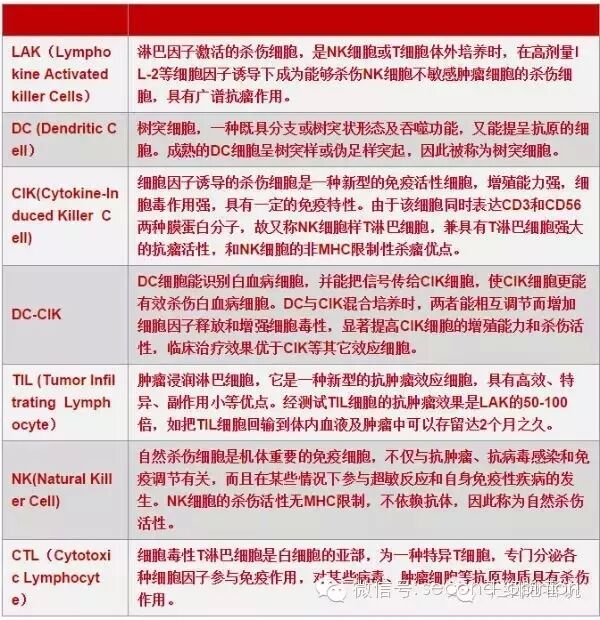
传统过继性免疫细胞
目前,国内有近200家公司在使用传统过继性免疫技术用于癌症临床治疗。一般采取为医疗机构提供免疫细胞治疗技术服务,并收取技术服务费的商业模式。公司选派专业技术人员在医院指定的细胞实验室内,按照医院为肿瘤患者制定的免疫细胞治疗方案,运用自身研发的免疫细胞治疗专利技术,对医院采集的患者血液样本进行细胞分离培养、体外扩增等处理后交还医院;医院将该细胞制剂回输至患者体内。医院支付公司技术服务费,而公司不参与患者的诊断及治疗方案的确定,也不向患者直接收取费用,仅仅作为细胞体外培养环节的技术供应商。
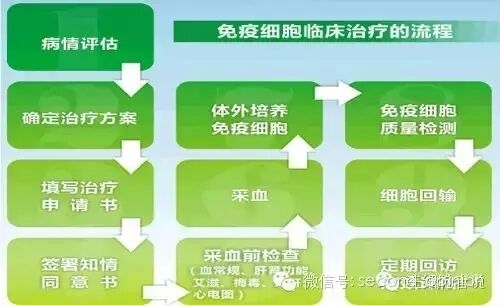
免疫细胞治疗流程
尽管各类传统过继性免疫细胞都对癌症有一定的效果,但是这些细胞的靶向性较差,往往很难表现出较为明显的治疗效果,大多用于辅助治疗或者术后提高机体免疫力,逐渐被欧美主流技术所淘汰。但由于这类免疫细胞客观上能够提升人体免疫力,而且均为自体细胞扩增,回输风险较小,未来有望在养生保健以及辅助治疗领域取得较大市场。
目前,世界各国都在积极开展CAR-T治疗技术开发和临床试验,包括美国、中国、英国、瑞典、日本等。国际制药巨头诺华公司率先和宾夕法尼亚大学合作开发CAR-T细胞免疫疗法的研究。随后礼来、葛兰素史克和辉瑞等医药巨头以及Juno、Kite等小型生物医药公司也竞相加入CAR-T细胞免疫技术研发的行列。这必将推动这一极具发展前景的肿瘤免疫治疗技术尽早进入临床应用阶段,从而为晚期难治性恶性肿瘤患者带来希望。
1.3 CAR-T:接过癌症免疫治疗大旗
T淋巴细胞是肿瘤细胞的天敌,在肿瘤免疫应答中起主要作用,对肿瘤细胞有极强的杀伤作用。但是,使用内源性T细胞进行肿瘤免疫治疗时,靶抗原需经过加工处理后才能和靶细胞表面的主要组织相容性复合物(main histocompatibility complex,MHC)作用,也即“MHC限制性”。然而,肿瘤免疫编辑的过程会使MHC在肿瘤细胞表面表达下降,破坏抗原加工过程,降低肽段免疫原性。这样长期形成的免疫逃逸机制,能使肿瘤细胞成功躲避T细胞攻击,肿瘤快速增殖。此外,人体内肿瘤特异性的T细胞数量较少,并且由于大多数肿瘤细胞不断表达自体抗原,使得靶向这些抗原的T细胞通过免疫耐受机制被中和或移除,数量进一步减少。因此,包括细胞因子诱导的杀伤细胞在内的T细胞过继性免疫治疗虽然在部分肿瘤的治疗中取得了一定的效果,但在大多数肿瘤中疗效尚不能令人满意。
CAR-T,全称ChimericAntigen Receptor T-Cell Immunotherapy,即嵌合抗原受体T细胞免疫疗法。通过将识别肿瘤相关抗原(tumor-associated antigen,TAA,是指一些肿瘤细胞表面糖蛋白或糖脂成分,它们在正常细胞上有微量表达,但在肿瘤细胞表达明显增高。)的scFv和胞内信号域“免疫受体酪氨酸活化基序(immunoreceptor tyrosine-based activation motifs, ITAM,通常为CD3ζ或FcεRIγ)”在体外进行基因重组,生成重组质粒,再在体外通过转染技术转染到患者的T细胞,使患者T细胞表达肿瘤抗原受体。转染后经过纯化和大规模扩增后的T细胞,也即CAR-T细胞,可以特异性地识别肿瘤相关抗原,使效应T细胞的靶向性、杀伤活性和持久性较常规应用的免疫细胞大幅提高,并可克服肿瘤局部免疫抑制微环境,从而打破宿主免疫耐受状态,杀灭肿瘤细胞。
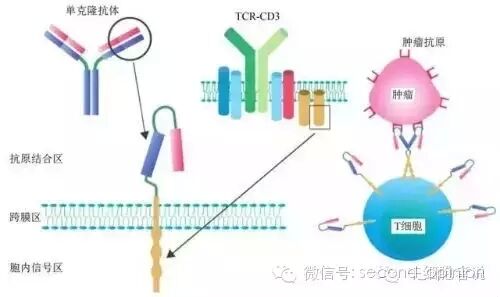
完整的CAR-T结构包括抗原结合区、跨膜链接区和胞内信号区三个部分。
1.3.1四代CAR-T 技术演进
研究表明,T细胞的完全活化有赖于双信号和细胞因子的作用。其中第一信号为特异性信号,由TCR识别抗原递呈细胞表面的抗原肽-MHC复合物所启动;第二信号为协同刺激信号,通过CD28/B7等重要的共刺激分子,促进IL-2合成,并使T细胞充分活化及免于凋亡。对于初始型T细胞(未与抗原接触的T细胞),如只在信号1而没有信号2条件下无法使T细胞发挥正常作用;即使T细胞与抗原接触, 如果没有协同刺激信号,细胞也不能发挥正常功能。相应的,仅含有CD3ζ序列的嵌合抗原受体,如没有协同刺激信号2,也是无法激活CAR-T细胞。因此,依照T细胞活化的双信号学说,第二和第三代CARs在嵌合受体上加上如CD28、CD134(OX40)和CD137(4-1BB)等共刺激分子(costimulatory molecule,CM),增加共同刺激因子的目的是提高T细胞的细胞毒性、增殖活性, 维持T细胞应答,延长T细胞存活时间等,从而增强CAR-T的效果。
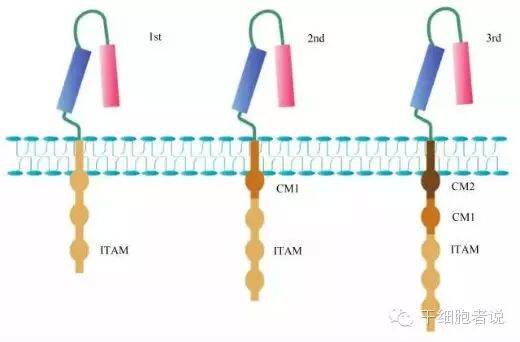
三代CAR-T胞内信号区变化
目前已经在开发的第四代CAR-T技术,包括整合表达免疫因子、整合共刺激因子配体等。可以想象,未来还会有更多的共刺激因子以及其他精确调控方式的加入,这也凸显了CAR-T的技术属性。

四代CAR-T技术
1.3.2 CAR-T治疗流程
一个典型的CAR-T治疗流程,主要分为以下五个步骤。
①分离:从癌症病人身上分离免疫T细胞。
②修饰:用基因工程技术给T细胞加入一个能识别肿瘤细胞并且同时激活T细胞的嵌合抗体,也即制备CAR-T细胞。
③扩增:体外培养,大量扩增CAR-T细胞。一般一个病人需要几十亿,乃至上百亿个CAR-T细胞(体型越大,需要细胞越多)。
④回输:把扩增好的CAR-T细胞回输到病人体内。
⑤监控:严密监护病人,尤其是控制前几天身体的剧烈反应。
整个疗程持续3个星期左右,其中细胞“提取-修饰-扩增”需要约2个星期,花费时间较长。
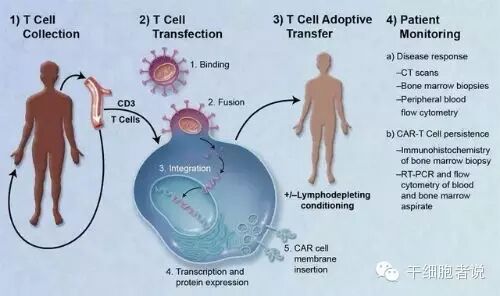
CAR-T治疗流程
1.3.3 CAR-T临床进展
CAR-T疗法是由美国宾夕法尼亚大学终身教授、美国科学院院士Carl June教授和他的团队首创。后来越来越多的科学家、医院和药企参与到CAR-T技术开发当中。随着不断取得的突破性进展,越来越多的投资机构也看到了这一疗法的前景,资金不断涌入,加速推动了技术进步。
说到CAR-T的临床进展,首先必须要提EmilyWhitehead的故事。5岁时,艾米丽被诊断出急性淋巴细胞白血病,在进行首轮化疗时受到感染,差点失去双腿。后来病情复发,她又接受了治疗,并排期做骨髓移植手术。等待期间,病情再次复发,这时医生们已经无计可施。随后接受Carl June的CART19细胞回输,Emily的体内发生了超强的免疫反应,连续几天发高烧,不得不入院治疗。高烧下的她产生了幻觉,问爸爸:“我房间里怎么有池塘?”经历了噩梦般的连续高烧后,Emily最终挣脱了死神的束缚重新醒了过来。现在Emily已经9岁,还在健康成长,体内仍然能检测到存活的CAR-T细胞。

CAR-T疗法发明人Carl June和无进展生存的Emily Whitehead
发表在Science上的文章“TheDizzying Journey to a New Cancer Arsenal”详细的记录了Carl June和他的团队关于CAR-T临床试验的研发过程。其中关于Emily的部分摘录如下…... Emily Whitehead, a 6-year-old with end stage leukemia whoseparents turned to June’s cell therapy as a last-ditch hope. The experimentaltreatment sent her body into a deadly immune overdrive. She spent 2 weeks on aventilator in the CHOP intensive care unit while doctors tried everything theycould think of to save her. “We thought it was over,” June says. Hedrafted an e-mail message to Penn’s provost: “It is with regret that I informyou that our fi rst pediatric patient on the CART19 trial will likely die,” hewrote. “There is nothing to do at this point other than hope for amiracle.”…... (Science.2013. 340. 1514-1518)
去年以来,几乎每月、甚至每星期都能听到CAR-T临床的新进展以及新技术的开发。现摘取其中一小部分如下。
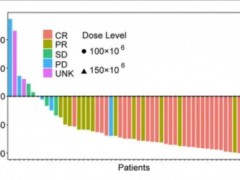
2014年12月10日,在第56届美国血液学会年会(ASH)上,诺华(Novartis)公布了其CAR-T免疫疗法CTL019的临床数据。在这些研究中,CTL019在某些类型淋巴细胞白血病表现出了巨大的治疗潜力。在一项长期儿科研究中,39例复发/难治(r/r)急性淋巴细胞白血病(ALL)儿科患者接受了CTL019的治疗,数据显示,有36例患者经历了完全缓解(CR),比例高达92%(n=36/39)。
2015年5月21日,在英国伦敦举行的第十届世界干细胞与再生医学大会,西比曼(Cellular Biomedicine Group)的首席执行官曹卫公布了其CAR-TCD30霍奇金淋巴瘤免疫-肿瘤研发项目的I期临床数据。7名患者中有5人对CAR-CD30 T细胞疗法有应答。该试验由中国解放军总医院设计并执行,项目主要负责人是该院癌症免疫治疗部门的主任韩卫东教授。
2015年6月2日,在美国临床肿瘤学会(ASCO)年会上,纪念斯隆凯特林癌症中心(MSKCC)公布了其CAR-T细胞治疗复发及难治性B细胞型非霍奇金淋巴瘤的临床一期实验结果。8名患者在大剂量化疗和自体造血干细胞移植后接受治疗,其中5名患者完全缓解(62.5%)。部分病人期间经历细胞因子风暴,通过使用 tocilizumab联合皮质类固醇治疗得到了有效控制。
Carl June教授在今年接受采访时表示:“CAR-T技术2010年开始做第一次临床实验,估计2017年美国FDA通过,只用7年的时间,这样是很快的。”
CAR-T疗法技术分析:优势明显,前景可期
2.1技术优势明显
2.1.1疗效更优
CAR-T疗法具有多种传统药物不具备的优点。相较于化疗药物和靶向药物,CAR-T的靶向性更强,并且可以通过技术修饰达到多靶向的目的。对于相同的靶点,CAR-T细胞均可进行特异性结合。由于CAR-T细胞中加入促进T细胞增殖与活化的基因序列,能保证T细胞进入体内后还可以增殖,可以长期在体内存活,使患者具有长期的免疫功能。

CAR-T技术疗效优势
2.1.2其他优势
技术属性强。从上文所述的四代CAR-T技术演进可以看出,通过探索完美的CAR信号组合、调节适宜的CAR亲和性、增加人工基因调控开关、产生合理的细胞因子分泌、诱导T细胞特异性归巢等技术手段,能够不断改进CAR-T疗效,提高其特异性,同时抑制副反应。
技术属性强的另一个表现是可复制性强。现在CAR-T疗法的原理已经基本探明,研发中常用的基因工程和细胞扩增-回输等手段也已经是常规技术,因此,CAR-T技术的可复制性较强。对于新药研发刚刚起步的中国,存在弯道超车的可能性。
相对轻资产。与资金需求密集、研发底蕴深厚的传统新药研发不同,CAR-T疗法研发对二者的需求相对较小。从纳斯达克上市的CAR-T相关企业可知,一家小型生物医药企业,只需要有一种特定的CAR-T技术即可迅速进行融资和临床试验。
临床审批快。由于CAR-T是一类全新的治疗手段,而且目前都是针对晚期恶性肿瘤患者,因此相应的临床试验中也不存在对照组的说法,因为没有参照物。这也使得CAR-T的临床审批天然具有相比于传统的小分子和大分子药物更快速的特点。
2.2 CAR-T目前面临的挑战以及应对
2.2.1 毒性和副反应
细胞因子释放综合征(CRS,也即细胞因子风暴)。这是CAR-T 技术在临床应用中一个最主要的不良反应,由于T细胞的大量增殖引起的细胞因子释放,引起机体出现发热或发烧,肌痛,低血压,呼吸衰竭等症状,严重时有生命危险。而针对CAR-T 细胞回输引起的细胞因子风暴,临床上利用IL-6受体拮抗药物tocilizumab能够缓解。同时有研究小组也观察到细胞因子风暴也与疾病进展程度或者肿瘤负荷有相关性,在高疾病负荷的患者体内,有较高的细胞因子释放。这意味着将CAR-T应用于疾病早期患者身上,在疾病恶化之前使用CAR-T来杀灭肿瘤,发生严重CRS风险将大大降低。
靶向/脱靶毒性(on-target/off-tumor)。由于CAR-T抗原的靶向性非常强,当肿瘤细胞和正常细胞含有相同抗原时,CAR-T细胞无法区分,从而对表达相应抗原的肿瘤细胞和正常细胞都具有攻击性。如针对CD19的CAR-T细胞治疗,会导致B细胞发育不良,靶向Her-2的CAR-T细胞治疗以及靶向MAGE-A3的TCR-T,都能导致肿瘤部位以外的其他组织或器官遭受攻击,例如产生心肺系统毒性。因此必须选择合适的肿瘤特异性抗原合成CAR-T,从而在攻击肿瘤细胞的同时能够区分正常细胞免受攻击。也就是说, CAR-T细胞特异性必须要满足技能杀伤癌细胞,又要避免对正常细胞的攻击。这意味着CAR-T疗法的研发必须是精准的、特异的,粗放的研发方式只会带来风险。
神经毒性。CAR-T治疗白血病会引起神经系统症状,这是一个预期之外且目前尚不清楚的现象。有几个研究小组报道,这些症状具有多样性但可自行消退,如谵妄、语言障碍、运动障碍、缄默症和癫痫发作。虽然与全身CRS的发生有些时间上的关联,当然也与CAR-T存在于脑脊液中相关,但是使用tocilizumab这些症状不会有改变。这些症状的机制与靶组织仍有待确认。
2.2.2技术难题
实体瘤效果较差。最成功的CD19-CAR-T,其治疗慢性淋巴性白血病的效果低于急性淋巴性,实体肿瘤的效果则差的更多。这是由于在实体肿瘤在慢性发展过程中,能够在体内构成一个微环境(TME,Tumor Microenvironment)。里面有浸润性的调节性T 细胞(Treg细胞)、肿瘤相关巨噬细胞、PD-1高表达以及抑制性细胞因子(比如白介素10、TGFb),从而将肿瘤保护得非常严密。静脉回输CAR-T细胞后,T细胞很难归巢到肿瘤位置,因此治疗效果较差。
第四代CAR-T技术中,会整合表达一个白介素12 因子(L12)的基因。白介素12 是很重要的因子,但不能直接给药,会产生严重反应。但在CAR -T上,让白介素12在靶向位置局部表达,可以改善免疫治疗的微环境。把附近的NK细胞召唤过来激活,并把浸润的T细胞功能唤醒,协助CAR-T细胞杀灭肿瘤细胞。另外,实体肿瘤里面有靶点阴性的细胞,因此把靶点阳性的细胞杀完,阴性的也会长起来。而把浸润的T细胞唤醒,可以杀灭靶点阴性的肿瘤细胞。
近期西比曼生物科技公司(纳斯达克股票代码:CBMG)公布了其实体瘤CAR-T数据。他们在多种类型肿瘤上均取得了应答,属于全球首次。

西比曼实体瘤数据
个性化的标准化。CAR-T作为一种个性化治疗,需要对每个病人进行特定的治疗,因此也造成治疗价格过高和疗效不确定性。尤其是疗效的不确定性,可能在某些患者身上能够发生奇迹,而在另一些患者身上却毫无反应。Carl June的团队就碰到了这样的问题。在无进展生存了三位患者后,2012年1月,他们使用了一种新载体制备CAR-T治疗另外3位患者,没有缓解。June的团队不知道发生了什么,甚至不知道是否载体材料出了错,或者这样的结果出于该疗法成功率的随机波动。(“I was just stumped out to the max,” June says. He had no idea whathad happened and still can’t say whether something went awry with the vectormaterial or whether the outcome was due to random fluctuations in the therapy’ssuccess. “All we knew was, it worked three times, and then it didn’t work threetimes.”)因此,如何将CAR-T治疗流程标准化是未来这种疗法是否能够进入临床造福患者的首要任务。
由于来自不同的病人,每批T细胞的质量可能参差不齐,其他科学和生产变量(嵌入外来 DNA 所用的载体、生长细胞的技术、以及它们如何运输等等)均会使结果难以预料。
例如在回输T细胞前,需要对病人进行预处理。如果不预处理的话,免疫系统里面充满免疫细胞,T细胞无法进入免疫系统。预处理的目的是使得免疫系统留出一些空间,然后让T细胞能在里面扩增。目前通常的做法是在CAR-T回输之前做小剂量的化疗预处理,然后再进行回输,CAR-T就会扩增的较好。类似的技术性的问题还有很多,因此如何将整个治疗流程标准化,仍然需要大量的临床研究探索。
传统药物是由药企成批制造,由医院或者药店供应给患者,整个过程中的生产和使用都是标准化的,虽然在临床使用阶段药品的用量和用法由医生针对患者的病情灵活使用,但基本差异不大。而CAR-T的供应链则完全不同。第一步细胞提取,医生就需要确定什么时候提取的细胞活性更好,但同时又必须考虑到病情已经到达晚期,每拖延一天就会耽误治疗时间。后续的基因工程修饰、扩增、回输、回输阶段的预处理、搭配使用的药物、药物使用时机以及实时监控等等步骤,都需要考虑到每位患者实际情况。当然这也带来了另一个问题:治疗价格昂贵。
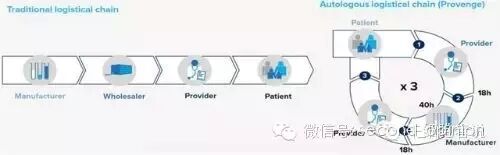
传统药物和CAR-T供应链比较
治疗价格昂贵。CAR-T疗法价格昂贵的首要原因在于前期巨额的研发成本—这也是所有创新药价格昂贵的共因;另一个重要原因则是CAR-T的个性化因素。CAR-T 细胞制备时间较长,过程个性化、定制化,无法实现规模化供应。普遍预计,CAR-T疗法在美国的价格可能达到20-30万美金/人,这还是针对诺华这样的巨头公司,可以通过规模化降低一部分成本。对于小型生物医药公司,单价甚至能够达到45万美金。
一个可能的解决方式是使用异体CAR-T细胞治疗,从而将自体CAR-T细胞“提取-修饰-回输”的供应链转变为传统药物的现货(Off- the-shelf)供应链。2015年11月6日,Cellectis的现货异体CAR-T向前迈出重要一步。一位只有11个月大的女婴因为难治性白血病(fatal,refractory leukemia)在使用该公司UCART19两个月后获得完全缓解。当天Cellectis股价上涨超过20%。尽管是个案并且观察时间较短,未来还需要进一步观察,但不管怎样,异体CAR-T是一条非常值得探索的途径。如果异体CAR-T最终可行,单例治疗价格可能下降到5-10万美金。
技术进化是否存在天花板。尽管多代CAR-T技术在不停的升级,但是值得我们警醒的是,这种技术同样可能存在治疗效果的天花板,产生耐药性。
CAR-T市场潜力巨大
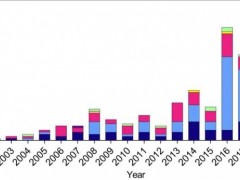
2013全球肿瘤药物市场规模达650亿美金(包含辅助治疗药物的市场规模达910亿美金),10年复合增长率14%,尽管今年来增长逐渐趋缓,但是仍高于整体医药市场的增长。预计到2018年,肿瘤类药物全球支出将达到1000亿美金,未来几年的绝对增长预计为250-450亿美元。其原因在于近年来肿瘤创新药物的激增以及研发进程的强劲表现持续推动肿瘤药物在全球的支出,并且到2020年癌症发病率也将持续地增长。
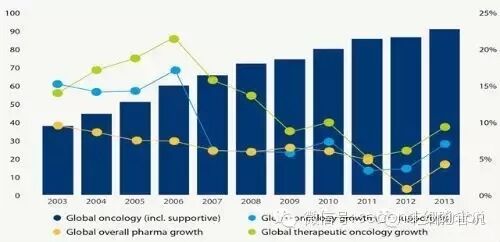
2003-2013年全球肿瘤药物市场数据(含辅助用药)
纯以市场的角度来看CAR-T,由于其单价(约30万美元/人,治疗过程14-21天)远高于常规疗法,未来可能覆盖的适应症较多,将有希望成为最有效和最常规的肿瘤治疗方式,因此CAR-T 疗法市场潜力巨大。因此,各大分析机构预计,基于CAR-T 细胞的肿瘤治疗市场空间可能达到350亿到1000亿美金。
我们根据美国《CA:肿瘤临床杂志》(CACancer J Clin)公布的2015年美国癌症发病率统计数据,预计2015年美国新增癌症患者165.84万人,死亡人数58.94万人,其中新增各类血液瘤患者人数达到16.20万人。按目前主流预计的CAR-T治疗费用(30万美金/人),美国每年新增血液瘤潜在市场规模将达到480亿美金。
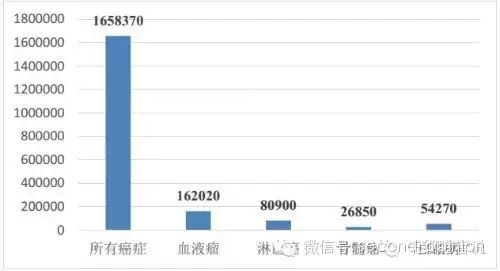
2015年美国预计新增血液瘤患者人数
2015年10月9日,国家癌症中心主任陈万青带领团队在国际著名癌症专业期刊《癌症通讯》(Cancer Letters)上首次发布了我国居民癌症统计数据。结果显示,我国5年内诊断为癌症且仍存活的病例数约为749万(其中男性患者368万人,女性患者381万人),总体5年癌症患病率为556/10万。
根据陈万青的统计,我国5年内诊断为癌症且仍存活的白血病患者人数为11.73万人、淋巴癌患者人数为15.76万人。考虑到CAR-T对血液瘤的突出疗效,按国内每人10万人民币的治疗费用,CAR-T疗法在这两大血液瘤的潜在市场规模就超过了250亿元。
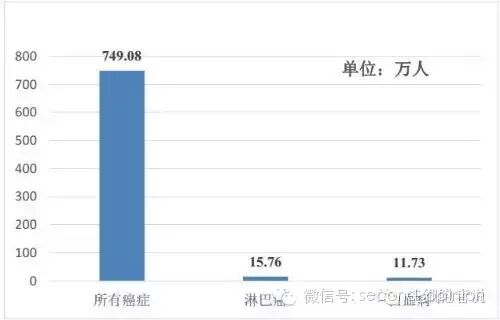
中国五年确诊存活患癌人数
2013年,中国肿瘤药物市场规模达320亿人民币,10年复合增长达24%,远高于全球增长,由十年前占全球肿瘤市场市场份额的1%猛增至2013年的5%,可以看出,中国在全球肿瘤市场的重要性正在不断的提升。其中的主要增长动因来自于:不断扩大的患者群体、患者支付能力提高、医保覆盖扩大、新产品上市以及日益增多的商业保险及病人支持项目。值得注意的是,由于目前癌症治疗的趋势是采用多种方式进行系统性治疗,CAR-T疗法并不会过分侵蚀其他疗法的市场份额,当然这也需要医保、商业保险等多方面的配合。
CAR-T研发格局
4.1美国遥遥领先,中国紧随其后,欧洲和日本大幅落后
截止目前,正在开展的CAR-T临床实验共76项,其中美国48项,中国19项,欧洲7项,日本和澳大利亚各一项。
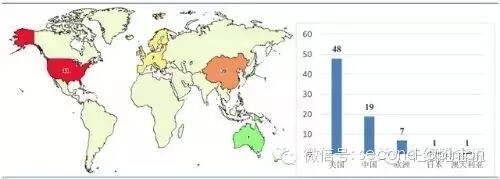
正在开展的CAR-T临床试验
美国是CAR-T技术的起源地,也是全球医药科技的龙头,各大医药巨头都对这一新兴领域垂涎三尺不足为奇。而中国作为最强大的跟随者,把握住了这一时代潮流,以惊人的19项临床试验位居全球第二,将传统医药强国日本和欧洲甩在身后。尽管国内部分CAR-T技术还相对落后,研发也较为粗放,但研发广度和深度均为世界前列。这也是为什么我们看好国内CAR-T研究的原因。
今年10月17日,由上海昆朗生物科技公司提供支持,在中国医学科学院血液病医院、江苏省人民医院、武汉同济医院等18家医院设立CAR-T临床研究中心。目的为了评价CAR-T治疗复发/难治性血液肿瘤的安全性和临床有效性,为更广泛的应用于临床治疗提供依据。该临床研究项目的持续时间是2年,包括启动阶段、入组病人CAR-T治疗阶段、短期随访阶段、长期随访阶段及临床数据总结阶段。这也是国内同类项目中包含的研究中心最多,入组病例数最多的一项研究项目。这一项目在降低病人负担的同时,也使得病人能够受益于CAR-T技术。值得注意的是,该项目参加的医院和病人数远远超过其他国内外药企,并且试验中所得到的数据更能体现中国人对该技术的反应,这无疑将是中国CAR-T研究和血液肿瘤患者的福音。
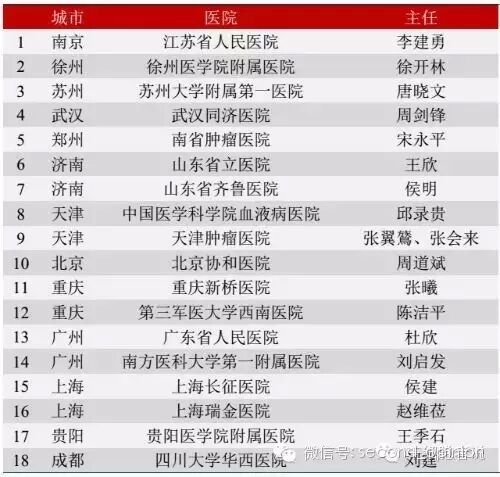
CAR-T临床研究中心
4.2监管落后于技术
美国明确地把医学干预手段药物分为三大类:小分子药物、大分子药物和细胞药物(也即以细胞做基础的治疗性分子,细胞治疗)。也就是说美国产学研界把细胞治疗当成和小分子药物、大分子药物三足鼎立的治疗手段。但是由于细胞药物是一种“活的”成分,所以它的监管模式、推广和传统药物不同。
细胞药物的这种特性使其监管较为困难,形成了一种技术领先、监管落后的局面。无论欧美还是中国,一方面希望能够进行免疫细胞的研究,一方面又对细胞疗法的临床以及上市持有相对谨慎的态度。这种“既鼓励又严管”态度从干细胞药物政策上也可见一斑。
客观上,这种“监管落后于技术”的现状给了中小公司高速发展的机会。小型生物医药企业研发项目少、效率高、政策成本低,能够更快速的推动细胞治疗技术,也是美国的VC/PE纷纷介入到中小生物医药公司的商业背景。
反观国内。2009年,卫生部颁布了《医疗技术临床应用管理办法》以及《首批允许临床应用的第三类医疗技术目录》将免疫细胞治疗技术纳入可以进入临床研究和临床应用的第三类医疗技术。然而后续的《自体免疫细胞治疗技术管理规范》仅出台了征求意见稿,正式稿迟迟没有出台,因此,国内细胞治疗领域处于监管空白期。
在医院和企业端,则都是相对更加积极的态度。因此,在监管缺位的情况下,一些小型生物科技公司和医院进行收费合作,将CAR-T作为临床应用,通过医院内部审批、签订免责协议等方式应用于癌症晚期患者。这样的灰色地带使得公司和医院获得了收益,客观上,也一定程度上造福了部分患者,当然其中存在着巨大的医疗风险和道德风险。
对于晚期癌症患者而言,更多是抱着死马当作活马医的态度,因为现有药物已经起不到任何延长生存期的效果,不如尝试新技术,还存在一线无进展生存的希望。
以类似的干细胞治疗为例,尽管美国和欧洲尚未正式批准干细胞药物上市,但是在加拿大、韩国、日本以及新西兰等国家都已批准多款干细胞药物。而中国在干细胞治疗上面的研究一直走在世界前列,但是目前在国内也仅能用于临床试验和临床应用,处于一个相对灰色的地带。联系欧美日韩的情况,未来干细胞药物必然存在大概率商业化的前景。同样,目前国内涉及CAR-T的小型生物科技公司相当之多,尽管存在一定的灰色地带,但是客观来说,也为国内CAR-T研究提供了一定的基础。尽管目前CAR-T疗法还处于临床试验阶段,但是根据血液瘤上已经成功的案例,我们认为,尽管道路曲折,但是未来免疫治疗领域必然有CAR-T的一席之地。
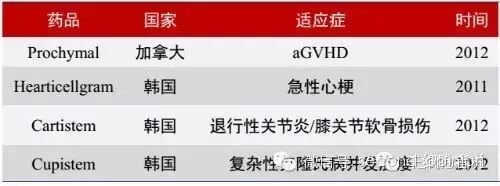
已批准的干细胞药物
相关上市标的
在美国,诺华、Juno和Kite的研究处于领先地位,相应的CAR-T技术也各具特色,并且在多项临床试验中率先获得了大量的数据,引领着CAR-T的潮流。还有多家小型生物医药公司,在各自的领域也都取得了一定的突破,例如上文提到的Cellectis公司。值得一提的是西比曼生物科技公司(CBMG),由国人创办,与解放军301医院韩为东教授合作,目前已经取得了国际领先的结果。各大传统医药巨头也通过并购或者合作的方式开展了CAR-T研究。
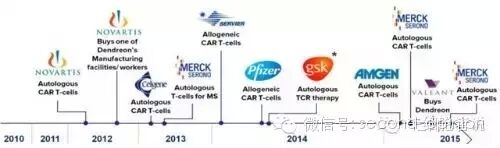
医药巨头CAR-T立项时间轴
而在A股,国内药企尚未直接开展CAR-T研究,但是通过并购整合也逐渐开始涉足。例如国内创新药企龙头恒瑞医药在今年与深圳源正细胞合作成立恒瑞源正生物科技有限公司,开始发力免疫疗法。安科生物也通过与博生吉合作进入了此领域。
在新三板,深圳合一康在立足传统免疫细胞治疗的基础上也开展了CAR-T治疗的基础研究并取得了一定的进展。
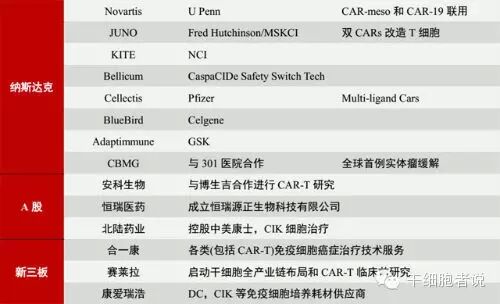
部分免疫细胞上市标的
本文转载自生物探索,来源:方正证券
转载仅作分享,如有侵权请联系我们,我们必会处理,万分感谢!全球肿瘤医生网