抗癌药品百科
全球肿瘤医生网不具备药品销售资格,不售卖任何药物,也不帮助患者代购药物。网上药品代购存在假药等风险,且代购均为违法行为,广大患者做好自我保护。

曲美替尼(Trametinib)
适应症:联合达拉非尼用于BRAF V600E突变阳性的转移性非小细胞肺癌(NSCLC)患者。 这是第一个FDA批准专门用于治疗BRAF V600E突变阳性转移性NSCLC患者!...
- 药物介绍
- 药物靶点
- 相关资讯
- 临床试验
曲美替尼(Trametinib)药物介绍
KRAS基因突变,是目前世界上最难对付的基因突变。在肺癌中,KRAS突变的患者对TKI药物疗效较差,同时针对KRAS突变位点的靶向药物研发难度较大,所以对于KRAS突变患者治疗从阻断下游通路(RAS-RAF-MEK-ERK-MARP)入手,MEK抑制剂是理想的KRAS突变肺癌的治疗药物。曲美替尼是一种MEK1/2抑制剂,主要通过对MEK蛋白的作用,影响MAPK通路,抑制细胞增殖。MEK是RAS和RAF的下游信号转导蛋白,因此曲美替尼针对具有RAS或RAF突变的癌种也可能有效。美国FDA批准其用于治疗BRAFV600E或V600K基因突变的不可切除或转移性黑色素瘤及与达拉非尼联合用于治疗BRAFV600E突变的转移性非小细胞肺癌(NSCLC)!
初识曲美替尼(trametinib)
曲美替尼是一种MEK1/2抑制剂,主要通过对MEK蛋白的作用,影响MAPK通路,抑制细胞增殖。MEK是RAS和RAF的下游信号转导蛋白,因此曲美替尼针对具有RAS或RAF突变的癌种也可能有效。如非小细胞肺癌、黑色素瘤、甲状腺癌。
美国药品名称:Mekinist
厂商:诺华/葛兰素
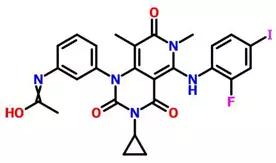
下面是曲美替尼的分子式:
FDA批准的临床适应症有哪些呢?
FDA批准曲美替尼
2017年6月22日:
联合达拉非尼用于BRAF V600E突变阳性的转移性非小细胞肺癌(NSCLC)患者。
这是第一个FDA批准专门用于治疗BRAF V600E突变阳性转移性NSCLC患者!
2014年1月10:
曲美替尼联合达拉非尼治疗不能切除或转移的BRAF V600E突变阳性的黑色素瘤患者。
2013年5月29:
治疗具有BRAF V600E或V600K突变的不可切除或转移性黑素瘤的患者。
曲美替尼的临床效果如何?
1
BRF113928 (NCT01336634)
2017年6月22日,FDA批准曲美替尼联合达拉非尼用于BRAF V600E突变阳性的转移性非小细胞肺癌(NSCLC)患者。此次获批是基于2期临床试验BRF113928研究数据。
实验设计:
93名患者接受达拉菲尼(150mg口服,每日两次)联合曲美替尼(2mg口服,每日一次),36例初次接受治疗,57例曾接受过化疗。
实验结果:
经过治疗,初治患者群总体缓解率达到61%;而曾接受过化疗的患者群总体缓解率更是达到了63%,中位缓解持续时间为12.6个月。
作为威胁人类生命健康的一种常见恶性肿瘤,在世界范围内,每年有约1800万人被诊断为肺癌,其中80%以上是NSCLC;而在所有NSCLC患者中,又有约1-3%的患者存在BRAF V600 突变。而且,这一类患者群体在以前的主要治疗手段只有化疗,几乎没有其他更好的可选方案!直到dabrafenib与trametinib组合疗法的出现,并先后获得了欧盟委员会与美国FDA的批准认可,堪称肺癌治疗领域的一个重要里程碑!
副作用:
发热、腹泻、恶心、呕吐、乏力、皮疹、食欲下降、水肿、咳嗽等症状,暂无严重副反应,安全性可控。
2
黑色素瘤I/II研究
2014年美国FDA批准MEK抑制剂曲美替尼和BRAF抑制剂达拉菲尼联合治疗BRAF V600E或V600K突变的不可手术或转移性黑色素瘤。该批准是基于一项开放的I/II研究。
实验设计:
共纳入晚期黑色素瘤患者162例,接受联合曲美替尼和达拉菲尼治疗。
研究结果:
与达拉菲尼单药治疗相比,曲美替尼和达拉菲尼联合治疗能有效提高总体反应率(ORR)。76%的病人肿瘤缩小或者消失平均时间为10.5个月。研究人员发现,相比之下,使用达拉菲尼单独治疗的病人,54%的病人肿瘤缩小或者消失平均时间为5.6个月。
副作用:
发烧,发冷,疲劳,皮疹,恶心,呕吐,腹泻,腹痛,手脚肿胀,咳嗽,头痛,关节痛,盗汗,食欲下降,便秘和肌肉痛。严重的不良反应包括出血,血栓,心力衰竭,皮肤和眼睛问题及肾损害。
FDA强调:应该告诫育龄妇女曲美替尼和达拉菲尼会导致婴儿出生缺陷,以及应该告知使用曲美替尼和达拉菲尼治疗可能导致不育。
3
黑色素瘤随机双盲研究
FDA于2013年5月批准曲美替尼(trametinib)(MEKINIST,葛兰素史克)治疗伴有BRAF V600E或V600K突变的不可切除或转移性黑色素瘤。
实验设计:
入组322例接受过≤1种化疗方案的患者的多中心、国际化、开放性、随机双盲研究
研究结果:
Trametinib组相较于化疗组PFS分别为4.8个月:1.5个月(P<0.0001),客观有效率为22%:8%。推荐剂量为:Trametinib 2mg po qd(餐前1小时或餐后2小时) 直到病情进展或毒副反应无法耐受。常见副反应包括皮疹、腹泻、淋巴水肿。Mekinist(trametinib)为首个MEK抑制剂,作为一种单药口服片剂,适用于携带BRAF V600E或V600K突变的手术不可切除性黑色素瘤或转移性黑色素瘤成人患者的治疗。
副作用:
皮疹,腹泻和淋巴水肿。
发生在服用trametinib的患者中的严重不良药物反应包括心肌病,视网膜色素上皮脱离,视网膜静脉阻塞,间质性肺病和严重的皮肤毒性。
该如何服用这种药物?
开始用MEKINIST治疗前确认在肿瘤样品中存在BRAF V600E和V600K突变。
MEKINIST的推荐剂量方案是2mg口服每天1次作为单药和与dabrafenib 150 mg联用口服每天2次。餐前至少1小时和餐后至少2小时服用MEKINIST。
剂型和规格
片:0.5mg,1mg,和2mg。
使用时需要注意的事项有哪些?
新原发恶性病,皮肤和非皮肤:当MEKINIST被使用与dabrafenib联用可能发生。治疗开始前和用治疗,和联合治疗终止后监视患者新恶性病。
出血:接受MEKINIST与dabrafenib联用患者可能发生重大出血事件。监视出血体征和症状。
静脉血栓栓塞:接受MEKINIST与dabrafenib联用患者可能发生深静脉血栓形成和肺栓塞。
心肌病:治疗前,治疗后1个月,其后然后每2至3个月评估LVEF。
眼毒性:对任何视力障碍进行眼科评价。 对视网膜静脉阻塞(RVO),永久终止MEKINIST
间质性肺疾病(ILD):对新和进展性不能解释的肺症状不给MEKINIST。对治疗-相关ILD和肺炎永久终止MEKINIST。
严重发热反应:当MEKINIST被使用与dabrafenib联用时可能发生。
严重皮肤毒性:监视皮肤毒性和继发感染。对不可耐受的2级,和3和4级皮疹尽管中断MEKINIST 3周内不改善终止用药。
高血糖:在预先存在糖尿病和高血糖患者监视血清糖水平。
胚胎胎儿毒性:可能致胎儿危害. 忠告有生殖潜能女性对胎儿风险。
常见的副作用有哪些?
MEKINIST作为单药常见不良反应(≥20%)包括皮疹,腹泻,和淋巴水肿.
曲美替尼与dabrafenib联用最常见不良反应(≥20%)包括发热,畏寒,疲乏,皮疹,恶心,呕吐,腹泻,腹痛,外周性水肿,咳嗽,头痛,关节痛,夜汗,食欲减低,便秘,和肌痛。
关于MEK:
MEK该属科学家们较早发现并有着充分研究的靶点之一。MEK(有丝分裂原激活蛋白激酶)可分为MEK1和MEK2,是RAS-RAF-MEK-ERK通路中重要的信号分子,在细胞增殖、细胞凋亡、细胞分化、肿瘤发生等方面发挥重要作用。
目前已有多个作用于MEK的靶向药进入临床试验,例如口服MEK抑制剂CI-1040用于晚期结肠癌、非小细胞肺癌、乳腺癌或胰腺癌患者的多个 II 期临床试验研究均已有报道。AZD6244(也就是我们认识的司美替尼)能抑制携带Q56P和K57N突变的肿瘤细胞增殖。
由此可见,很多种癌的发展都与MEK有关,抑制MEK便成了控制很多种癌的手段之一。到目前为止,除了包含MEK靶点的多靶点的多吉美和索坦外,还有专门单一抑制MEK的,就是Trametinib(曲美替尼/Mekinist)和Selumetinib(AZD6244/司美替尼);还有前面提到的CI-1040。
当然,要使用MEK抑制剂,前提就是必须检测到MEK基因的存在。
推荐的临床试验(患者可申请):
1、Trametinib联合多西他赛治疗复发或IV期KRAS突变阳性非小细胞肺癌!( NCT02642042 )
该II期试验研究了trametinib和多西他赛如何在治疗IV期KRAS突变阳性非小细胞肺癌或已经复发的癌症患者中起作用。Trametinib可以通过阻断细胞生长所需的一些酶来阻止肿瘤细胞的生长。化疗中使用的药物,如多西紫杉醇,以不同的方式阻止肿瘤细胞的生长,或者杀死细胞,阻止它们分裂,或者阻止它们扩散。给予trametinib与多西紫杉醇可能更好地治疗非小细胞肺癌。
实验地点:
1、加州大学戴维斯分校综合癌症中心
2、洛杉矶癌症中心

立即申请
想参加本临床试验的患者可关注全球肿瘤医生网微信公众号,根据提示提交病历资料,医学部会初步评估是否适合,并尽快与您联系,也可致电400-666-7998咨询详情。
2、达拉菲尼与Trametinib联合治疗BRAF V600E-突变罕见肿瘤患者的疗效和安全性( NCT02034110 )
这是一项Dabrafenib联合Trametinib的II期开放标签非随机多中心研究,用于罕见癌症患者,包括甲状腺未分化癌,胆道癌,胃肠间质瘤,非精原细胞性生殖细胞肿瘤非恶性生殖细胞肿瘤,毛细胞白血病,1或2级胶质瘤,3或4(高级)神经胶质瘤,多发性骨髓瘤和小肠腺癌,BRAF V600E阳性-mutations。本研究旨在确定口服达拉菲尼联合口服Trametinib治疗罕见BRAF V600E突变患者的总有效率(ORR)。受试者将需要提供新鲜或冷冻的肿瘤组织样品以确认BRAF V600E突变状态。只有组织学确诊为晚期疾病且没有可用标准治疗方案的受试者才有资格报名参加。在开始治疗之前,受试者将在14天内(眼科检查,超声心动图)进行筛选评估,以确定其入选研究的资格。
实验地点:
1、加州大学洛杉矶分校/ Jonsson综合癌症中心
2、MD安德森癌症中心
3、美国国家卫生研究院临床中心
4、麻省总医院
5、布列根和妇女医院

立即申请
想参加本临床试验的患者可关注全球肿瘤医生网微信公众号,根据提示提交病历资料,医学部会初步评估是否适合,并尽快与您联系,也可致电400-666-7998咨询详情。
如果您想了解
1、 用曲美替尼是否需要做基因检测?
2、 曲美替尼只能在美国购买吗?价格多少?有什么副作用吗?
可致电全球肿瘤医生网医学部(400-666-7998)咨询!
更多药品信息请致电400-666-7998
声明:
本公众号内容仅作交流参考,不作为诊断及医疗依据,仅依照本文而做出的行为造成的一切后果,由行为人自行承担责任。专业医学问题请咨询专业人士或专业医疗机构。
曲美替尼(Trametinib)药物靶点
曲美替尼(Trametinib)药物相关资讯
曲美替尼(Trametinib)药物临床试验
曲美替尼(Trametinib)药物热门问答
曲美替尼(Trametinib)药物资讯
-

6款第一、二、三代铂类化疗药物顺铂、卡铂、环硫铂、奈达铂、奥沙利铂、洛铂大盘点
以临床最常用的化疗药物类型之一,铂类化疗药为例,铂类化疗药共分为三代,这些药物的适应症及不良反应之间有非常独特的区别,不同药物之间交叉耐药情况也有差异。
-

刚刚!各类癌症的五年生存率及化疗成功率统计数据出炉
关于化疗,各种流言从未间断:化疗杀敌一千,自损八百癌症患者是死于化疗,而不是癌症本身化疗副作用极其痛苦且让人死得更快....
-

化疗各种毒性反应 1~4 级是啥?有这几张表就够了
化疗不仅存在诸多不良反应,给人身带来不同程度的损伤,而且随着化疗疗程的加长,化疗的敏感性越来越差,甚至产生耐药,治疗效果
-

人参皂苷抗癌抗肿瘤,人参皂苷的作用和功效是可以联合放化疗、靶向药可减轻副作用,抑制癌细胞
参的主要药理活性成分人参皂苷已被证明具有多种药用效果,包括突出的抗癌活性。
-

基因检测无突变怎么办,基因检测没有突变怎么办,别慌,化疗药也有全新进展
如果基因检测发现了突变自然是好的,意味着患者可以开始尝试各类靶向药物;但并非每位患者都能通过基因检测发现有药物的靶点,而且还有一部分患者,因为耐药等原因而陷入了无靶向药可用的境地。
-

收藏|如何对抗化疗期间的各种副作用?方法都总结在这了!
在癌症治疗领域,虽然靶向药和免疫疗法越来越普遍,但化疗、放疗还是很多癌症的首选治疗方案。由放化疗引起的副作用让很多患者的
-
癌症肿瘤患者怎么提高免疫力,胸腺肽的功能作用与功效可能90%的患者都不知道
人们可能因多种原因而免疫功能低下,包括高龄、代谢紊乱(如糖尿病)、癌症治疗,甚至癌症本身。
-

【抗癌日报】-大麻联合化疗比单独化疗延长3倍生存期
1、研究发现能阻止乳腺癌转移的方法约翰斯霍普金斯大学的研究人员报告说,在实验室培养的小鼠组织中证实,乳房乳管周围的细胞层































