时间:2022-05-31 15:17 编辑:全球肿瘤医生网
速递|靶向CD19的CAR-T疗法Kymriah(Tisagenlecleucel)获批用于治疗二线或以上全身治疗后的复发或难治性滤泡性淋巴瘤
Kymriah获批上市
2022年5月27日,FDA加速批准了诺华的CAR-T细胞疗法Tisagenlecleucel(Kymriah),用于治疗二线或以上全身治疗后的复发或难治性滤泡性淋巴瘤成年患者。
该批准基于Ⅱ期ELARA试验(NCT03568461)的数据。值得注意的是,在接受过大量预处理、即前线接受过多种治疗的患者当中,仍然观察到了良好的响应。
2021年ASCO大会上公布的结果显示,使用Tisagenlecleucel治疗,在可评估的94例患者当中,完全缓解率高达66%,整体缓解率86%。治疗6个月时,95%的患者仍保持着临床缓解,76%的患者保持着无进展生存。
研究者表示,受试的患者当中,高达78%的患者对于之前接受的最后一次治疗没有任何响应。而Tisagenlecleucel的疗效是令人鼓舞的,它使包括这部分前线治疗无效的患者在内的绝大部分患者,都达到了临床缓解。
关于Tisagenlecleucel
Tisagenlecleucel是一款CAR-CD19 T细胞制剂,也曾经是首款获得FDA批准的CAR-T细胞疗法,目前已经在世界30余个国家获批了至少1种适应症。
这款CAR-T产品能够与CD19蛋白结合,对于部分白血病和淋巴瘤有非常出色的疗效。此前,Tisagenlecleucel已经获批了B细胞急性淋巴细胞白血病等适应症,并且投入临床使用。
关于CAR-T疗法
CAR-T细胞疗法的名声,在新兴的免疫治疗领域可以说是非常的响亮,作为细胞免疫的代表之一而受到广泛的重视。
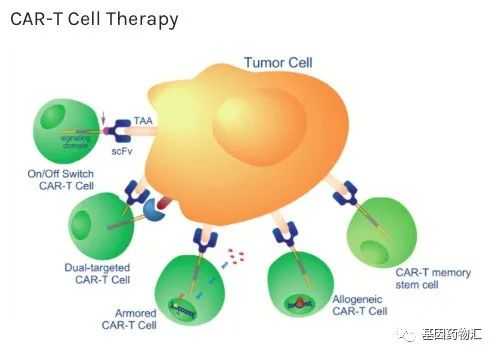
通常情况下,CAR-T细胞疗法的流程从提取患者自身免疫T细胞开始。通过分离患者自体免疫T细胞,并在体外对这些细胞进行基因改造,为它们装备能够识别癌细胞表面特定抗原的嵌合抗原受体(CAR),能够将这些抗癌能力普通的免疫细胞,改造成抗癌能力更加强大的CAR-T细胞。
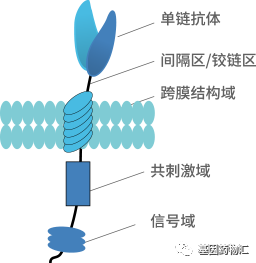
随后,在实验室中将这些接受了改造的CAR-T细胞大量扩增,再输注回患者体内。回到患者体内之后,这些特殊的T细胞就如同装备了新武器的军队,如虎添翼,能够对细胞进行更加有效的杀伤。
这样的特点与优势,使CAR-T细胞疗法成为了癌症治疗的一个全新的突破点、热点,获得了越来越多的认可,在更多的适应症上得到了应用。
治疗费用昂贵?参与临床试验,免费用药的机会来了
当然,这样一款新兴治疗方案的花费显然是不菲的。在三款已经获批的CAR-T细胞产品中,其中相对便宜的Yescarta费用为37.3万美元,Kymriah的费用更是高达47.5万美元。即使是在中国上市的价格,首款CAR-T制剂的价格也达到了120万元一针。
我国是CAR-T细胞疗法研究及临床试验项目最多的国家,大量国内中心的试验项目正在招募中国患者。对于符合适应症需求的患者来说,这是一个提前享受新药治疗且避免巨额开销的好渠道。
希望尝试CAR-T疗法以及其它免疫细胞疗法的患者,可以联系基因药物汇了解详情。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。