时间:2022-07-22 11:18 编辑:全球肿瘤医生网
乐普生物免疫治疗药物(PD1)普特利单抗注射液(Pucotenlimab)获批上市
2022年7月22日,中国国家药品监督管理局(NMPA)官网最新公示,乐普生物抗PD-1抗体普特利单抗注射液的上市申请已获得批准。公开资料显示,此次该产品获批的适应症为:适用于既往接受一线及以上系统治疗失败的微卫星高度不稳定(MSI-H)/错配修复功能缺陷(dMMR)实体瘤患者的治疗。

截图来源:NMPA官网
据乐普生物早前公开资料介绍,普特利单抗(pucotenlimab)是通过使用人IgG4亚型针对人PD-1的人源化单抗。它可以拮抗PD-1信号,通过阻断PD-1与其配体PD-L1及PD-L2的结合来恢复免疫细胞杀死癌细胞的能力。同时,普特利单抗采用抗体工程技术,于Fc区引入突变,提高FcRn的结合亲和力,从而大幅延长其半衰期,提高患者的临床疗效及药物依从性。
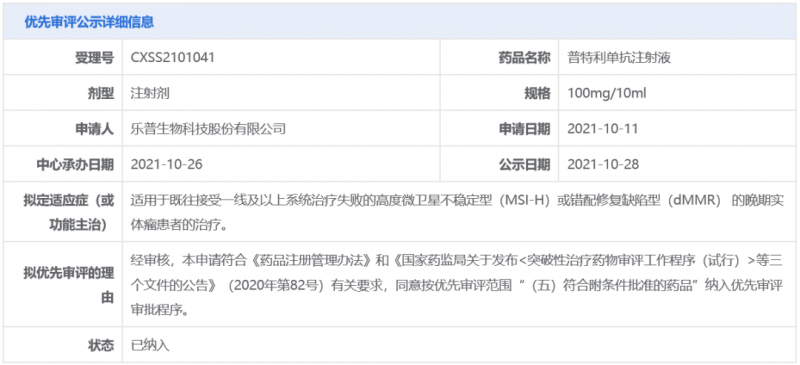
根据公开资料,乐普生物分别于2021年6月和2021年10月向NMPA提交了普特利单抗的2项适应症上市申请,分别用于治疗黑色素瘤和MSI-H/dMMR实体瘤。其中,MSI-H/dMMR实体瘤的上市申请还曾被中国国家药监局药品审评中心(CDE)纳入优先审评,具体适应症为:适用于既往接受一线及以上系统治疗失败的MSI-H或dMMR的晚期实体瘤患者的治疗。
截图来源:参考资料[3]
此次,普特利单抗获批的适应症即为MSI-H/dMMR实体瘤。MSI-H与dMMR是常见的遗传异常,含有这类变异的肿瘤会影响细胞内的DNA修复机制,可出现在乳腺、前列腺、结直肠、胃等多个部位。
在2021年美国临床肿瘤学会(ASCO)会议上,乐普生物汇报了普特利单抗用于MSI-H/dMMR实体瘤的多中心2期临床研究结果。数据显示,在共纳入100名均为二线及以上的患者中,86例达到初步反应评价。研究主要终点客观缓解率(ORR)达到47.67%,疾病控制率(DCR)为75.58%,6个月和12个月无进展生存期(PFS)率分别为62.66% 和52.70%。结果表明,普特利单抗在二线及以上MSI-H/dMMR晚期实体瘤患者中显示出有希望的疗效和可控的安全性。
除了MSI-H/dMMR实体瘤,乐普生物还在其它适应症上探索普特利单抗的治疗效果,例如黑色素瘤、胃癌或胃食管结合部癌二线治疗、非小细胞肺癌(NSCLC)、三阴性乳腺癌(TNBC)、非肌层浸润性膀胱癌(NMIBC)、肝细胞癌(HCC)等。此外,该公司还正在开展普特利单抗与溶瘤病毒产品、抗PD-L1抗体等联合疗法的临床试验。
希望乐普生物普特利单抗此次获批上市,能够为更多癌症患者提供新的治疗选择。
参考资料:
[1]2022年07月22日药品批准证明文件待领取信息发布 .Retrieved July 22,2022, from https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20220722090109108.html
[2]乐普生物招股书. Retrieved Apr 28, 2021, from https://www1.hkexnews.hk/app/sehk/2021/103373/documents/sehk21042802764_c.pdf
[3] Efficacy of HX008 in high microsatellite instability/mismatch repairdefificient (MSI-H/dMMR) solid tumors: Results from a multicenter phase II open-label study. From https://ascopubs.org/doi/abs/10.1200/JCO.2021.39.15_suppl.2572
[4]乐普生物发布2021年全年业绩报告|资本市场助力,临床管线多点开花 . Retrieved Mar 29,2022, from https://mp.weixin.qq.com/s/V_3DiYK0FrqsVEC40dh0vg
内容来源:医药观澜
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。