时间:2024-10-25 15:07 编辑:全球肿瘤医生网
第一位患者完成持久性体内CAR-T治疗,更多的CAR-T细胞疗法帮助患者延长生存期
一直以来,CAR-T细胞疗法面临一个难以逃避的问题,对于某些病情危重的患者而言,制造过程所需的等待时间实在太长了,大约数月左右。相关调查显示,约25%的患者在等待细胞制备过程中,癌症可能会发展到不可控的程度。因此,研究人员一直致力于同种异体CAR-T细胞疗法的研发,即利用健康捐献者的T细胞制备CAR-T,这样既可省去患者漫长的等待时间,又可省去单个疗法制造过程中的繁琐环节,从而使治疗成本大大下降。
如今这项研究终于取得了突破性进展,2024年10月23日,《精准医学》杂志报道,首位患者接受了名为INT2104的CAR-T体内基因治疗,这是一种基于慢病毒的基因疗法,可靶向CD20阳性B细胞,用于B细胞恶性肿瘤的治疗,这也是首次在临床上使用持久性体内CAR疗法!与传统的体外CAR-T制备方式相比,其价格更加低廉、患者等待治疗的时间更短,如果能顺利推进,或将解决CAR-T疗法又贵又费时的难题,让更多的癌症患者获益!
▲截图源自PRECISION MEDICINE
更快更便宜的异体通用型CAR-T疗法,为抗癌治疗注入新活力
其实除了开篇提到的这款首次在临床上使用持久性体内CAR疗法INT2104外,还有两款异体通用型CAR-T细胞也引起了广泛关注。
其一,是由我国研究团自主研发的一款针对CD19的异体通用型CAR-T细胞,这也是全球首个通用CAR-T细胞,并成功登上了全球知名期刊《Nature》官网的头条!
其二,就是P-BCMA-ALLO1,它是一款非病毒、富含干细胞记忆T细胞的CAR-T细胞产品,它在2024年9月17日,获得了美国FDA授予的再生医学先进疗法(RMAT)资格,用于复发/难治性多发性骨髓瘤的治疗。
P-BCMA-ALLO1:多发性骨髓瘤ORR高达91%
P-BCMA-ALLO1的1/1b期临床试验(NCT04960579)数据,已在第21届国际骨髓瘤学会年会上公布。本次研究共入组72例复发/难治性多发性骨髓瘤(RRMM)患者,给予同种异体BCMACAR-T细胞疗法P-BCMA-ALLO1治疗。
结果显示:在23例先前接受过大量治疗的患者中,总体反应率(ORR)高达91%!其中,在未接受BCMA治疗的患者中,ORR更是高达100%!而接受过1种BCMA靶向治疗(n=14)、Talvey和/或1种BCMA靶向治疗(n=7)的患者,其ORR也达到了86%(详见下图)。
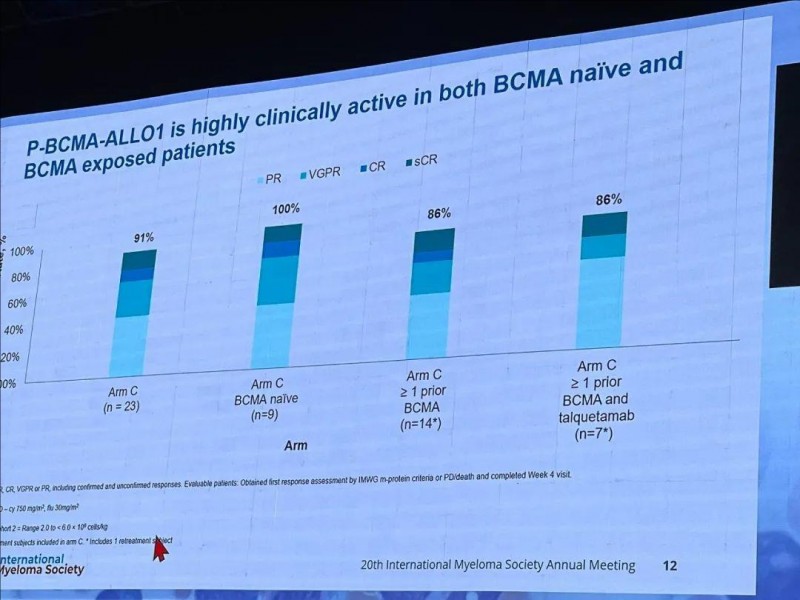
▲图源OneLive,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
多款新型CAR-T细胞疗法:复发或难治性血液肿瘤患者的新救赎
CLL1 CAR-T:髓外/无髓外浸润白血病均有效,中位总生存长达466天
急性髓细胞白血病(AML)是一种血液系统的常见癌症,表现为骨髓内异常髓细胞的快速生长,导致健康血细胞的生成受到损害。约10%~20%的AML患者有髓外浸润病灶(EMD),此类患者预后通常较差,病程更具侵袭性,部分复发或难治性患者无法实现长期生存。而近年研究显示,CLL1 CAR-T疗法在复发或难治性AML患者中显示出良好的疗效和安全性。
我国进行的一项关于CLL1 CAR-T疗法,治疗急性髓细胞白血病(AML)的临床研究,共入组47例AML患者,其中包括27例单纯骨髓浸润患者,20例同时存在骨髓浸润及髓外浸润(EMD)患者。既往治疗线数中位数为4(范围:2~13)。入组接受CLL1CAR-T细胞治疗后,结果显示:
1、缓解率:全部入组的47例患者中,有35例获得完全缓解(CR),CR率高达74.5%。其中,无髓外浸润(EMD)患者的缓解率为81.48%(22/27),而存在EMD患者的骨髓缓解率为65.00%(13/20)。
2、中位总生存期(OS):全部入组患者(n=47)的中位总生存期(OS)长达466天,其中,单纯骨髓受累患者和EMD患者的OS分别为586天 vs 301天。此外,6个月OS率分别为82.60%(单纯骨髓受累患者) vs 63.09%(EMD患者);12个月OS率分别为66.72%(单纯骨髓受累患者) vs 45.17%(EMD患者),详见下图。
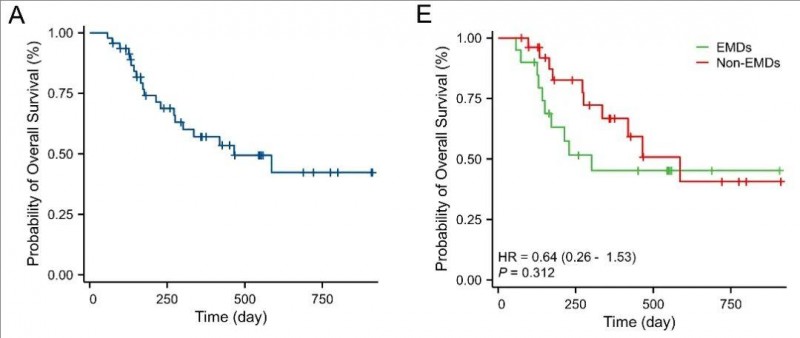
▲图源BMC,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、中位无进展生存期(PFS):全部入组患者(n=47)的中位无进展生存期(PFS)长达282天,其中,单纯骨髓受累患者和EMD患者的PFS分别为341天 vs 258天。此外,6个月PFS率分别为85.64%(单纯骨髓受累患者) vs 74.29%(EMD患者);12个月OS率分别为44.86%(单纯骨髓受累患者) vs 37.14%(EMD患者),详见下图。
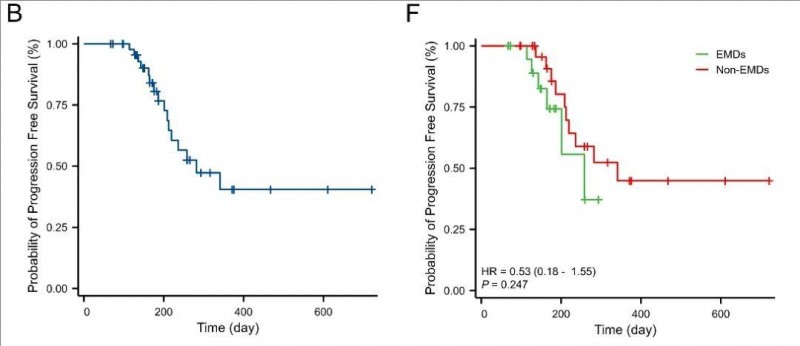
▲图源BMC,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
综上,CLL1 CAR-T疗法对伴有EMD的AML患者的治疗效果,同时表明并发症的发生率在可承受范围内,为AML患者提供了新的希望与选择!
案例分析
值得一提的是,一位44岁的女性,在CLL1 CAR-T细胞治疗后,髓外肿瘤灶几乎被根除。PET-CT显示,治疗前该患者髓外代谢肿瘤体积(MTV)达到30.35cm3,而治疗35天后达到完全代谢反应(CMR)。提示CAR-T疗法,对减轻AML髓外浸润有显著疗效。
▼该患者在CLL1 CAR-T细胞治疗前后,PET-CT 成像对比
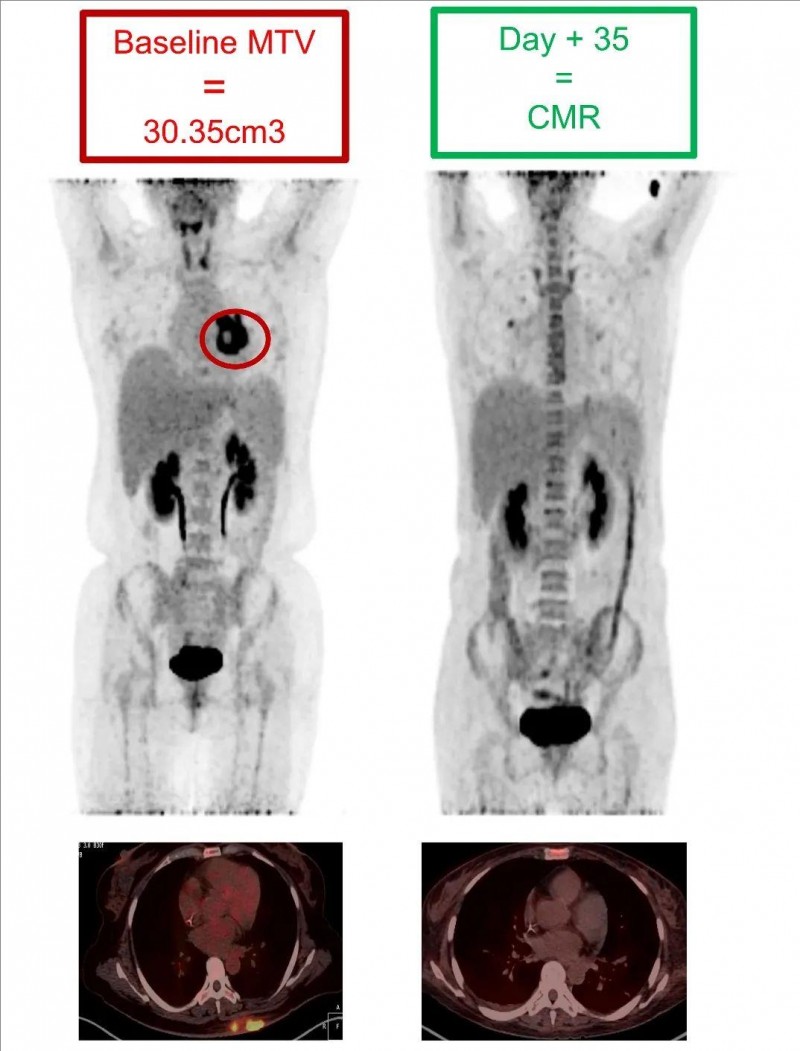
▲图源BMC,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
注:红色圆圈表示:最具代表性的髓外病变部位。
中国患者如何寻求CAR-T疗法帮助?
目前,国内有多家癌症中心,已启动CAR-T细胞疗法的临床实验,主要针对各类晚期血液肿瘤、多款实体瘤,包括但不限于胃癌、胰腺癌、肠癌、鼻咽癌、肝癌、卵巢癌、间皮瘤、B淋巴细胞白血病、多发性骨髓瘤、急性髓系白血病、非霍奇金淋巴瘤等。
想寻求CAR-T疗法帮助的患者,可先将病历及近期病理检查报告,提交至医学部,进行初步评估,一旦审核通过,将有机会获得这款天价疗法免费治疗的机会。
CD22 CAR-T:大B细胞淋巴瘤完全缓解率超50%
CD19 CAR-T疗法改善了复发或难治性大 B 细胞淋巴瘤(B-ALL )的预后,长期随访发现约30%~50%的复发或难治性大 B 细胞淋巴瘤患者有持久反应。但部分经CD19 CAR-T治疗后复发的患者预后则不理想,即便重新输注 CAR19 产品,也并未产生有意义的持久反应。而近年研发发现,CD22作为一种几乎普遍表达的 B 细胞表面抗原,是B-ALL 的有效治疗靶点,有望改善经CD19 CAR-T( CAR19)治疗后病情进展的复发或难治性大B 细胞淋巴瘤患者的预后。
一项应用CD22 CAR-T,治疗大 B 细胞淋巴瘤的1 期临床试验(NCT04088890),共入组38例 CAR19治疗后复发或患有CD19 阴性大 B 细胞淋巴瘤的成年患者(年龄18 岁),这些患者既往接受过中位数为四线的治疗(范围 3-8)。
入组接受CD22 CAR-T治疗后,结果显示:总体缓解率(ORR)为 68%(95% CI 5183),完全缓解率(CR)高达53%(范围:3669)。此外,所有患者的中位总生存期(OS)为 14.1 个月(范围:9.1NE);中位无进展生存期(PFS)为 3.0 个月(范围:1.8NE)。
▼下图显示所有接受治疗的患者(n=38)的反应持续时间和输注后的生存期
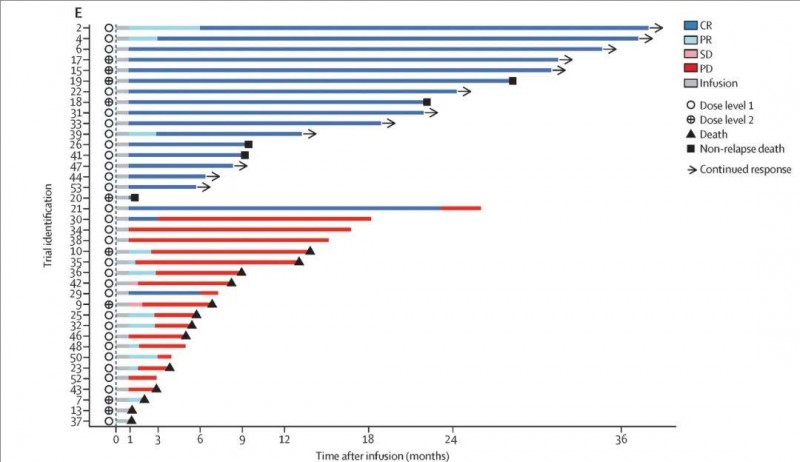
▲图源Lancet,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
HBI0101暴击复发/难治性多发性骨髓瘤,客观缓解率高达90%
部分多发性骨髓瘤(MM)患者会对主要抗骨髓瘤疗法(如蛋白酶体抑制剂、免疫调节剂等)产生耐药性,这类患者往往预后不佳,总生存期(OS)和中位无进展生存期(PFS)仅为10.3个月、2.8个月。因此,迫切需要寻求新的治疗方法,改善耐药患者的预后。
在第21届国际骨髓瘤学会年会上,公布的一项名为HBI0101的靶向B细胞成熟抗原(BCMA)的新型CAR-T疗法引起了广泛关注,该药在治疗复发和难治性多发性骨髓瘤(R/R MM)中,获得了高达90%的客观缓解率(ORR)。
HBI0101的1期临床研究(NCT04720313)共入组50例年龄18岁的复发和难治性多发性骨髓瘤(R/R MM)患者,既往接受过3种治疗,包括蛋白酶体抑制剂、免疫调节剂、抗CD38抗体。入组接受HBI0101输注后,结果显示:
1、客观缓解率(ORR):全部入组患者的ORR高达90%(n=45),其中严格意义上的完全缓解(CR)/CR率(sCR/CR)为56%(n=28),非常好的部分缓解(VGPR)率为22%(n=11),部分缓解率为12%(n=6),微小残留病(MRD)阴性率为74%,详见下图。
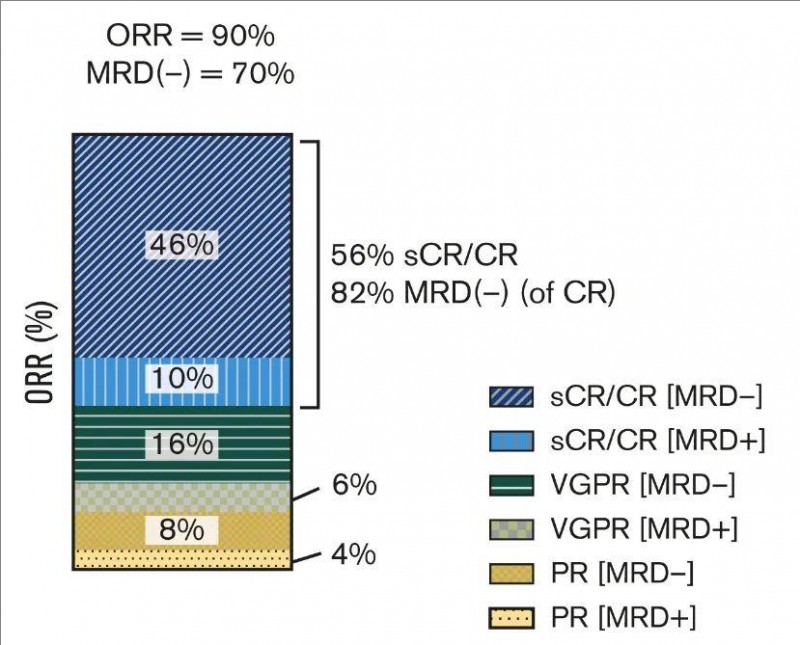
▲图源Blood,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、中位无进展生存期(PFS):中位PFS为334天(95%置信区间[CI],187-444),中位缓解持续时间为309天(95%CI,166-532)。
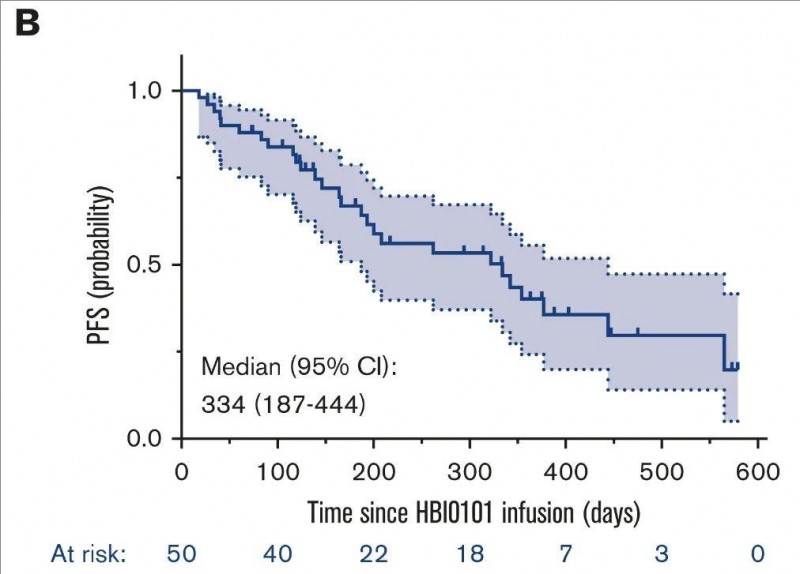
▲图源Blood,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、总生存(OS)率:1年时的预估OS率达到0.75(95%CI,范围:0.15-0.39)。
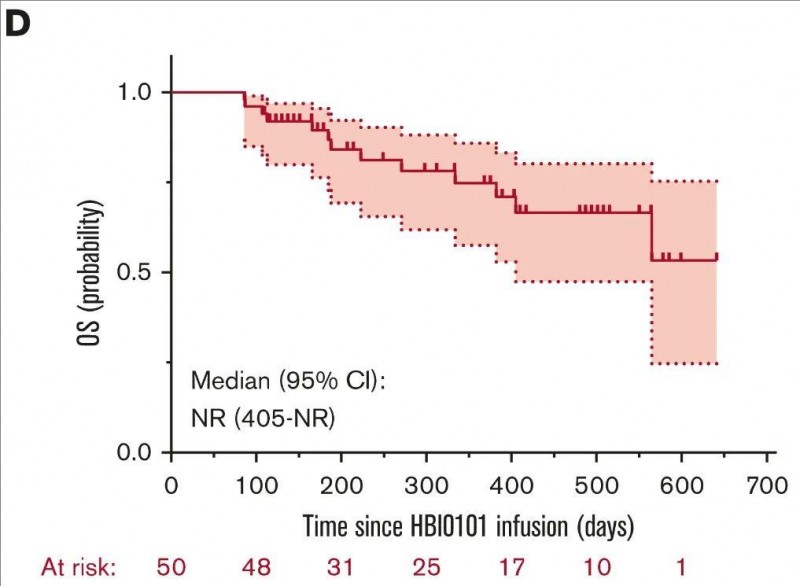
▲图源Blood,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
小编寄语
CAR-T细胞疗法作为肿瘤免疫治疗中的佼佼者,在治疗恶性肿瘤,尤其是血液肿瘤方面的成绩有目共睹,不仅有10多款产品相继获批上市。而且近年来,各国研究人员正在不断拓展CAR-T疗法的应用范围,并致力于研发异体CAR-T细胞疗法,以解决现有CAR-T细胞疗法制备时间过长、治疗费用过于昂贵等问题,力求让越来越多的癌症患者能受益,这也是无数癌症患者的共同心声!
如果您对现有的治疗方法不满意,或想寻求CAR-T、CAR-NK等新型抗癌疗法的帮助,可将治疗经历、出院小结、近期病理及影像学检查结果等,提交至医学部,进行初步评估或申请国外内抗癌专家会诊。
参考资料
[1]Zhao Y,et al.Efficacy and safety of CAR-T therapy targeting CLL1 in patients with extramedullary diseases of acute myeloid leukemia[J]. Journal of Translational Medicine, 2024, 22(1): 888.
https://translationalmedicine.biomedcentral.com/articles/10.1186/s12967-024-05705-7
[2]Frank M J,et al.CD22-directed CAR T-cell therapy for large B-cell lymphomas progressing after CD19-directed CAR T-cell therapy: a dose-finding phase 1 study[J]. The Lancet, 2024, 404(10450): 353-363.
https://www.thelancet.com/journals/lancet/article/PIIS0140-6736(24)00746-3/fulltext
[3]Kfir-Erenfeld S,et al.Clinical textareauation and determinants of response to HBI0101 (BCMA CART) therapy in relapsed/refractory multiple myeloma. Blood Adv. 2024 Aug 13;8(15):4077-4088.
https://pmc.ncbi.nlm.nih.gov/articles/PMC11342176/
[4]https://www.insideprecisionmedicine.com/topics/precision-medicine/first-patient-dosed-with-in-vivo-gene-therapy-for-car-t/
[5]https://www.onclive.com/view/p-bcma-allo1-may-be-safe-rapid-and-active-allogeneic-car-t-cell-therapy-in-pretreated-r-r-myeloma
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。