肺癌晚期临床试验,晚期肺肿瘤临床试验进行中,七款药物免费用
作为发病率与死亡率都排在全球首位的癌种,近两年,肺癌新药的进展和获批都呈现井喷状态,仅上半年,两大重磅抗癌新药LOXO-292和卡马替尼接连提前获批上市。不得不说,这是一个充满希望和奇迹的时代,给更多的患者带来了新的选择和希望。
但是这些上市新药都远在美国,价格昂贵,中国的病友仅有个别经济条件雄厚的患者选择前往美国接受治疗,大部分病友只能望药兴叹。
好消息是,目前国外上市的以及中国自主研发的几款抗肿瘤新药开始招募国内患者了!这意味着,国内的患者也终于有机会免费用上这些堪称天价的抗癌新疗法!
EGFR 20外显子插入突变
1、疾病控制率100%,我国自主研发广谱新药JMT-101重磅登场!临床招募进行中
EGFR是肺癌最常见的突变类型,但在这类突变中,有一类比较罕见的突变亚型-EGFR 20号外显子插入突变,对于各类EGFR-TKI药物均不敏感,患者治疗难度很大。幸运的是,针对EGFR 20号外显子插入突变这一突变类型,近两年许多新药试验均在如火如荼地进行当中。
非常振奋人心的是,2019年,我国自主研发的、专门针对EGFR ex20in患者的新药JMT-101已经获得批准投入临床试验!并且在2020年ASCO线上会议中,首次公布了这款药物治疗晚期结直肠癌患者的试验结果,疾病控制率达到100%,引起轰动。
好消息是,目前JMT-101治疗多种实体瘤的Ⅰ期临床试验已经陆续开始。其中,治疗非小细胞肺癌的Ⅰb期试验正在招募患者。
试验名称
评价JMT101联合阿法替尼或奥希替尼治疗EGFR 20号外显子插入突变的ⅢB 或Ⅳ期非小细胞肺癌患者的安全性和有效性的Ⅰb期临床研究
试验分期
Ⅰb期
主要纳入标准
1.年龄18~75(含)周岁,性别不限;
2.ⅢB或Ⅳ期非小细胞肺癌,不适合进行根治性手术或放疗,且证实具有EGFR 20号外显子插入突变(包括重复突变),初治或一线治疗失败后的患者;
3.基线至少存在一个符合RECIST 1.1标准定义的可测量的病灶;
4.ECOG体能状态评分:0或1分;
5.预计生存时间≥3个月等。
主要排除标准
1.既往接受过EGFR单克隆抗体靶向治疗;
2.具有临床症状的中枢神经系统转移或脑膜转移;
3.在首次使用研究药物前4周内接受过其他治疗方案等。
ALK突变
2、有效率83.3%!创新型二代ALK抑制剂CT-707临床招募中!
据统计,中国每年约有2~7万人罹患ALK阳性肺癌,占肺癌病人的3%~11%,虽然已有五款药物获批,但目前仅有克唑替尼,阿来替尼,色瑞替尼在国内上市,价格昂贵,可及性和高昂的费用这两大“拦路虎”使得很多癌症患者“望药兴叹”。
近期,由我国首药控股自主研发的1类创新药CT-707,也是全新结构的二代ALK抑制剂在国际上大放异彩。在北京协和医院进行的Ⅰ期临床试验数据显示,不管是初治的患者,还是克唑替尼耐药的患者,CT-707的有效率均在85%以上,疾病控制率均为100%!这款药物堪称国药之光!
目前,一项评价 CT一 707 治疗克唑替尼耐药的晚期 ALK 阳性非小细胞肺癌患者有效性和安全性的 二期多中心临床研究,由中国医学科学院肿瘤医院牵头,全国共计36 家中心正在招募患者。
主要入组标准
.年满 18 一 75 周岁,男女不限;
.克唑替尼耐药后
.近 4 周未参加过其他研究性药物临床研究;女性患者未处在怀孕期,试验期间同意采取避孕措施;
.既往细胞毒类化疗未超过 2 线;
.组织学或细胞学检查证实的 ALK阳性。
MET突变
3、疾病控制率97.2%!肺癌新药伯瑞替尼临床试验招募进行中
MET的主要突变类型为MET 14外显子跳跃突变,最早发现于20年前,但直到近几年,针对这一靶点的药物研究才正式开展。
近期,我国药企自主研发的c-MET抑制剂药物伯瑞替尼(Bozitinib)获得了相当理想的疗效数据。
在近期AACR大会上报道的数据显示:在所有36例可评估疗效的患者中,伯瑞替尼的客观缓解率(ORR)为30.6%(11/36) ,疾病控制率(DCR)为94.4% (34/36)。
目前,伯瑞替尼的Ⅱ期临床招募正在进行中,国内患者免费使用c-MET靶向药的机会来了!
实验名称
一项在c-MET异常的晚期非小细胞肺癌患者中评估伯瑞替尼肠溶胶囊有效性和安全性的多中心、多队列、开放的Ⅱ期临床研究
招募患者数量
85人
纳入标准
1.年龄≥18岁,男性或女性;
2.经组织学或细胞学证实的晚期非小细胞肺癌患者;
3.EGFR wt、ALK重排阴性、ROS1重排阴性、KRAS突变阴性;
4.经证实存在c-Met异常,c-Met异常,包括以下两种类型:①c-Met外显子14突变;②c-MET扩增,GCN≥6;
5.ECOG评分0~1分;
6.预期生存期≥3个月等。
ROS1突变
4、缓解率87.5%!TQ-B3101潜力非凡
ROS1是继靶向药物研发最多的EGFR靶点与疗效惊人的“钻石突变”ALK之后,肺癌患者、尤其是非小细胞肺癌患者应当重点关注的又一重要突变位点。针对ROS1靶点的已获批药物整体疗效较好,且在研药物种类繁多,患者生存希望比较乐观。目前,多种针对ROS1靶点的靶向药物已经获得FDA批准或NCCN指南推荐,另有多款药物在研,有望在未来投入临床,服务于患者。
一款由国内药企正大天晴药业集团自主研制的ROS1靶点新药TQ-B3101在Ⅰ期试验中展现出了卓越的疗效。在发布于2020 ASCO年会上的数据中,在接受350 mg bid治疗的8例患者中,整体缓解率达到了87.5%;此外,TQ-B3101同样具有通过血脑屏障的能力,在基线有脑转移的8例患者中,整体缓解率达到了62.5%。基于这项卓越的一期数据,二期临床试验也顺利开展了,由由中国医学科学院肿瘤医院牵头,共28家临床机构参与,由由中国医学科学院肿瘤医院牵头,共28家临床机构参与,目前正在招募患患者。
试验名称
评价TQ-B3101胶囊单药治疗ROS1阳性非小细胞肺癌患者疗效和安全性的II期单臂、多中心临床研究
入组标准(部分)
1.患者年龄≥18岁;
2.ECOG评分0~1分,预期生存期超过3个月;
3.通过组织学或细胞学证明诊断为局部晚期或转移性非小细胞肺癌;
4.提供ROS1阳性书面报告,或在入组前提供组织学标本、活检组织标本送中心实验室进行检测,并确认为ROS1阳性;
5.既往接受过不超过2个化疗方案(若接受超过2个化疗方案,则需再次进行检测,且检测结果确认为ROS1阳性)。
RET突变
5、RET抑制剂BLU-667
RET激酶的基因组改变包括融合和点突变,从而导致RET信号过度活跃和细胞生长不受控制。RET融合和突变发生在多种肿瘤类型中,且发生频率不同。据统计,在非小细胞肺癌里面,大约1%-2%的患者有RET基因融合。
2020年5月8日,全球首款用于治疗RET基因变异的靶向药selpercatinib上市,同时,另一款疗效卓越的RET抑制剂Pralsetinib(BLU-667,帕拉西替尼)也紧跟步伐,预计将于2020年11月23日前做出审批决定。
在2020年5月29日ASCO大会上最新公布的 数据中,显示了帕拉西替尼强大的抗癌功效,NSCLC患者中的总体缓解率(ORR)为61%,95%的患者观察到肿瘤缩小,其中14%的患者达到完全缓解!
目前这款药物正在国内进行临床招募。
试验目的
确定每种肿瘤类型的客观缓解率,并明确BLU-667的安全性和耐受性。
入组条件(部分)
1.非小细胞肺癌患者必须有病理学证实和确诊的携带RET融合的局部晚期或转移性非小细胞肺癌,未接受过治疗。
2.甲状腺髓样癌患必须有病理学证实和确诊的晚期MTC,在筛选访视之前14个月内疾病已进展,且既往未接受过治疗。
3.患有携带RET突变或融合的其他实体肿瘤。
4.有可测量病灶。
5.同意提供肿瘤组织以进行RET状态确认。
6.签署知情同意书。
申请方式
做过基因检测的病友,请将报告发送至全球肿瘤医生网医学部,我们的专家将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用。
1.请将基因检测报告,诊断报告电子版或拍照发送至doctor.huang@globecancer.com,邮件中留下联系方式,医学部收到报告分析完毕后一个工作日内电话联系。
2.直接致电全球肿瘤医生网医学部400-666-7998咨询相关
NTRK融合突变
6、有效率75%!"治愈系"抗癌药拉罗替尼招募实体瘤
去年7月,拉罗替尼将在国内开展临床招募的信息公布后,引起了广泛的关注,经过半年多的审批流程,近日,我们得到拜耳公司的最新信息,目前“治愈系”抗癌药拉罗替尼针对成人实体瘤和儿童实体瘤的两项试验终于正式在国内开始招募患者了!这意味着,国内的患者也终于有机会免费用上这款美国的抗癌“特药”!原文链接:终于来了!堪称天价的“治愈系”抗癌药拉罗替尼正式在国内开展临床试验!
成人实体瘤招募信息
这项研究是为了验证拉罗替尼对不同类型的肿瘤疗效。这些肿瘤必须存在一种特定的基因变化(NTRK1, NTRK2或NTRK3)。Larotrectinib是一种试验性的药物,可以阻止这些NTRK基因在癌细胞中的作用,因此可以用来治疗肿瘤。
试验分期
II期
研究机构
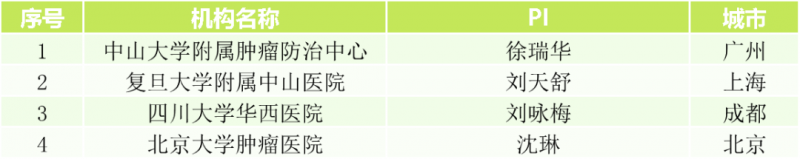
儿童实体瘤招募信息
本研究是验证拉罗替尼在儿童肿瘤患者中的安全性。该肿瘤必须存在特定(NTRK)基因改变。拉罗替尼旨在限制肿瘤细胞中NTRK基因的活性而治疗肿瘤。研究的第一部分(I期)验证儿童受试者中,剂量的安全性,药物在体内的吸收和改变,对于肿瘤的作用。第二部分(II期)主要目的是药物治疗的作用及其时长。
研究机构

7、横跨十大癌症!高效抗脑转抗癌药恩曲替尼招募开始
2019年8月,FDA加速批准了全球第三款广谱“治愈系”抗癌药Entrectinib(Rozlytrek,恩曲替尼,RXDX-101)上市,用于治疗成人和儿童患者神经营养原肌球蛋白受体激酶(NTRK)融合阳性、初始治疗后局部晚期或转移性实体肿瘤进展或无标准治疗方案的实体瘤患者,以及ROS1阳性非小细胞肺癌(NSCLC)患者。
临床数据显示:对于携带神经营养性酪氨酸受体激酶(NTRK),ROS1或间变性淋巴瘤激酶(ALK)融合的儿童肿瘤类型对治疗的响应率高达100%(完全缓解和部分缓解)!包括难治的中枢神经系统中的肿瘤!这个数字是史无前例的,相信给儿童肿瘤患者打开了一扇全新的希望之门。
1)在NTRK融合阳性实体瘤患者中,entrectinib(恩曲替尼,RXDX-101)的客观缓解率ORR(肿瘤缩小)为57.4%,并且在横跨10种不同类型肿瘤中均观察到了客观缓解(肿瘤缩小)。存在脑转移的患者中,entrectinib的颅内客观缓解率ORR为54.5%,其中超过1/4实现完全缓解(病灶全部消失)。
2)在局部晚期或转移性ROS1阳性非小细胞肺癌NSCLC患者中,临床试验结果表明,在51名ROS1阳性NSCLC患者中,总缓解率达到78%,完全缓解率达到5.9%。
经过国内近半年的审批流程,近日,我们得到罗氏公司的信息,目前“治愈系”抗癌药恩曲替尼针对成人实体瘤的临床试验终于正式在国内开始招募患者了!儿童患者的招募也正在协商中。这意味着,国内的患者也终于有机会免费用上这款美国的抗癌“特药”!这对于所有国内的患者来说又多了一份“治愈”的希望!
成人实体瘤招募信息
这项 Entrectinib治疗携带 NTRK1/2/3、ROS1或 ALK基因重排的局部晚期或转移性实体瘤患者的开放性、多中心、全球性 II期篮式研究,来确定携带NTRK1/2/3、ROS1或ALK基因重排的每类实体瘤患者人群(篮子)接受Entrectinib治疗后的客观缓解率(ORR)。
试验分期
II期
入组条件(部分)
1. 经组织学或细胞学确诊为局部晚期或转移性实体瘤,而且根据Foundation Medicine, Inc.或CLIA认证或同等机构认可的当地诊断实验室采用任何核酸类诊断检测方法进行的检测,该肿瘤携带一种预计分别转化成具有一个功能性TrkA/B/C、ROS1 或ALK激酶结构域的融合蛋白的NTRK1/2/3、ROS1或ALK基因重排,且不同时存在第二种致癌因素(例如EGFR、KRAS);
2. 对于通过当地实验室分子检测入组的患者,要求提交存档或新鲜的肿瘤组织(除非存在医学禁忌),在Foundation Medicine, Inc.(不服不行!全球肿瘤基因检测行业标杆-Foundation Medicine!)或该地区其他认可的中心实验室进行独立中心分子检测;
3. 根据当地采用RECIST v1.1进行的评估,疾病可测量。
申请方式:
做过基因检测的病友,请将报告发送至全球肿瘤医生网医学部,我们的专家将为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用。
1.请将基因检测报告,诊断报告电子版或拍照发送至doctor.huang@globecancer.com,邮件中留下联系方式,医学部收到报告分析完毕后一个工作日内电话联系。
2.直接致电全球肿瘤医生网医学部400-666-7998咨询相关医生。







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城