质子治疗的优势,质子放疗优势:笔形束扫描可降低乳腺癌患者继发癌症风险
近年来,乳腺癌发病率一直居女性恶性肿瘤发病率前列。据世界卫生组织发布的2020年全球最新癌症数据,乳腺癌已成为全球最常见癌症。详情请见质子中国往期报道《世卫组织公布2020最新全球癌症数据:乳腺癌取代肺癌,成为全球第一大癌症》。在乳腺癌的治疗中,质子治疗(PT)受到越来越多的关注。
鉴于现代治疗可延长早期乳腺癌患者的预期寿命,最近关于放疗诱导的继发性癌症风险(SCR)开始受到人们越来越多的关注,特别是对年轻患者。有研究表明,全乳放疗可导致继发性肺癌的额外死亡率为2.9%,高于晚期心脏毒性反应导致的预期死亡率。质子治疗由于其独特的剂量学优势,可以有效地减少周围危及器官的剂量,最大限度的降低放疗诱导的继发性癌症风险。
日前,来自意大利Trento大学物理系的研究人员针对不同程度淋巴结转移的乳腺癌患者采用光子3D适形放疗(3D-CRT)、容积弧形调强放疗(VMAT)技术及质子笔形束扫描技术(PBS),比较了不同治疗技术对肺和对侧乳腺的继发性癌症风险的影响。原文发表于Radiation Oncology杂志。

患者与治疗计划
研究纳入10例左侧乳腺癌且累及淋巴结的患者,将其分为两组进行分析研究。第1组为含锁骨上淋巴结(SVC)照射的5例患者,第2组为含SVC+内乳淋巴结(IMN)照射的5例患者。第1组患者在自由呼吸(FB)的情况下,比较质子治疗与3D-CRT计划。第2组患者在FB和深呼吸屏气(DIBH)两种情况下,比较质子治疗与VMAT计划。
研究人员使用RayStation治疗计划系统来计算和优化质子治疗计划,并假设RBE值恒定为1.1,并使用蒙特卡罗算法计算剂量分布(相关统计不确定性设置为1%)。束流能量范围为70到228 Mev。质子束光斑在空气中等中心点的半高宽在最低和最高能量时分别是大约16毫米到4毫米。切向3D-CRT和VMAT技术的光子放疗方案则使用Monaco治疗计划系统进行计算和优化。其中,MC算法用于计算VMAT的剂量分布(相关统计不确定度为1%),而切向3D-CRT则使用CCC算法进行计算。对于VMAT技术,研究人员使用两个部分弧(约240度)照射,而切向3D-CRT计划则基于野中野切向技术加SVC淋巴结前野照射。
所有计划均采用每体素2 mm³的剂量网格。每种治疗技术的处方剂量相同,均为总剂量50 Gy,分次剂量2 Gy。为简便起见,所有剂量单位均用Gy表示。对于质子来说,这些是Gy(RBE)值,因为其包含了常数RBE因子的乘积。
风险建模
研究人员的兴趣集中在同侧肺、对侧肺及乳腺继发癌症风险的计算上。采用施耐德提出的EAR公式来量化与每个计划相关的继发癌症风险。这是根据原子弹幸存者数据得出的低剂量基线危险度(EAR 0)与器官当量剂量(OED)的概念相结合,并假定两者成正比关系:
![]()
其中,OED的概念是假定如果一个器官内的所有剂量分布导致相同的辐射诱发癌症发生率,那么它们都是等效的。因此,OED是通过将DVH中所包含的信息与描述辐射诱发癌症的剂量反应曲线结合起来计算得出的。该项研究采用了三种不同的剂量响应模型,即线性模型、线性-指数模型和线性-平台模型:
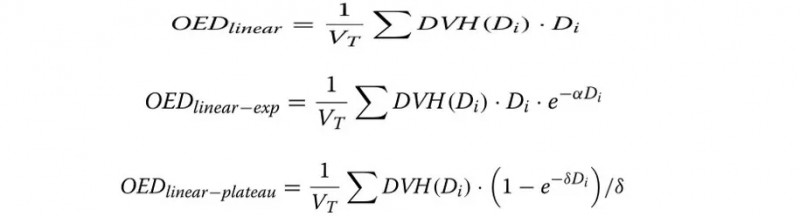
其中,α=0.044 Gy-1,δ=0.139 Gy-1。用于描述OED对剂量依赖性的三种不同模型对应于对潜在剂量响应曲线的不同假设。具体来说,线性模型假设OED对剂量是简单线性依赖关系。相反,线性-指数模型和线性-平台模型考虑了辐照后细胞修复/再生的可能性。更具体地说,这两种方法对应于极端情况:线性指数模型假设没有修复/再增值,而线性平台模型假设完全修复/再增值。
统计分析
对不同处理方法获得的的EAR进行统计学差异分析。具体来说,对比研究采用双尾配对T检验,p<0.05时,被认为具有显著差异。
结果
图1给出了一个具有代表性的患者在不同照射方式下的剂量分布。结果显示,与3D-CRT和VMAT相比,PT的适形性更好,且射野外的剂量分布明显更低。
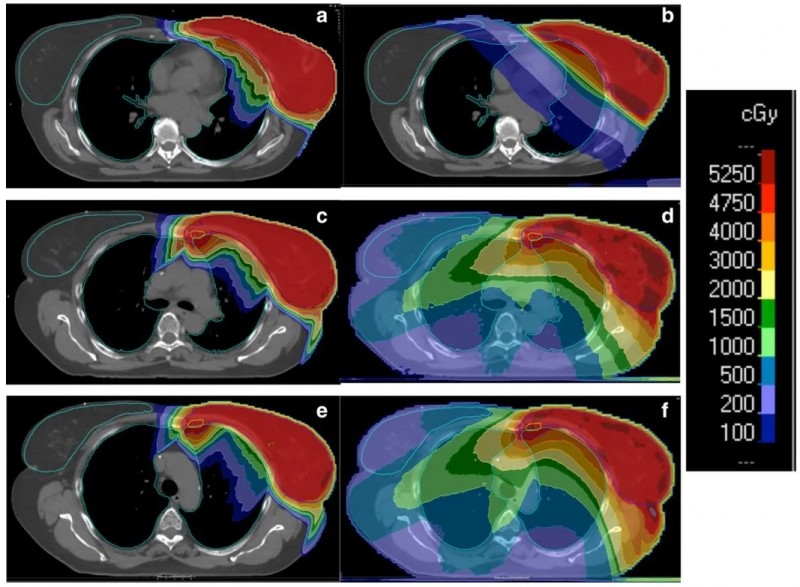
图1. 不同照射技术得到的剂量分布情况:第一组患者接受PT照射的剂量分布(a)与接受3D-CRT照射的剂量分布(b);第二组自由呼吸患者接受PT照射的剂量分布(c)与接受VMAT照射的剂量分布(d);DIBH患者接受PT照射的剂量分布(e)与接受VMAT照射的剂量分布(f)。结果可以观察到剂量分布对患者定位(FB VS DIBH)的依赖性有限。
表1总结了不同照射技术下危及器官的剂量受量。正如研究人员预期的那样,当SVC节点只包含在靶区中时,1组患者危及器官的总体剂量较低。在这种情况下,切向3D-CRT向同侧肺照射的剂量约为PT的3倍,而对侧器官的剂量低于1 Gy。
表1. 纳入患者SCR评估中的危及器官剂量学参数
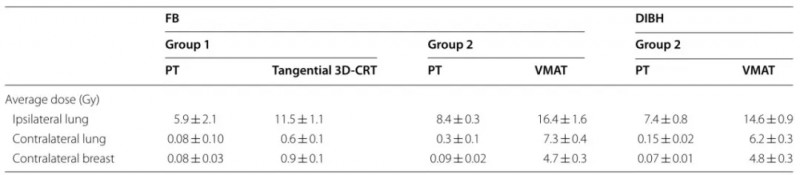
与第1组相比,第2组患者由于累及IMN,对同侧肺的PT剂量增加了2.5 ~ 2.8,且对患者固定设备依赖性较低(FB或DIBH照射)。相比于质子照射,VMAT的剂量大约是PT的两倍;而对于对侧危及器官,PT和VMAT的剂量有显著差异:PT的平均剂量远低于1 Gy, 而VMAT对对侧肺和乳腺的平均剂量分别约为6~7 Gy和5 Gy,且对FB或DIBH依赖性较小。图2中展示的两个治疗组的平均累积DVH进一步证实了该剂量学结果。
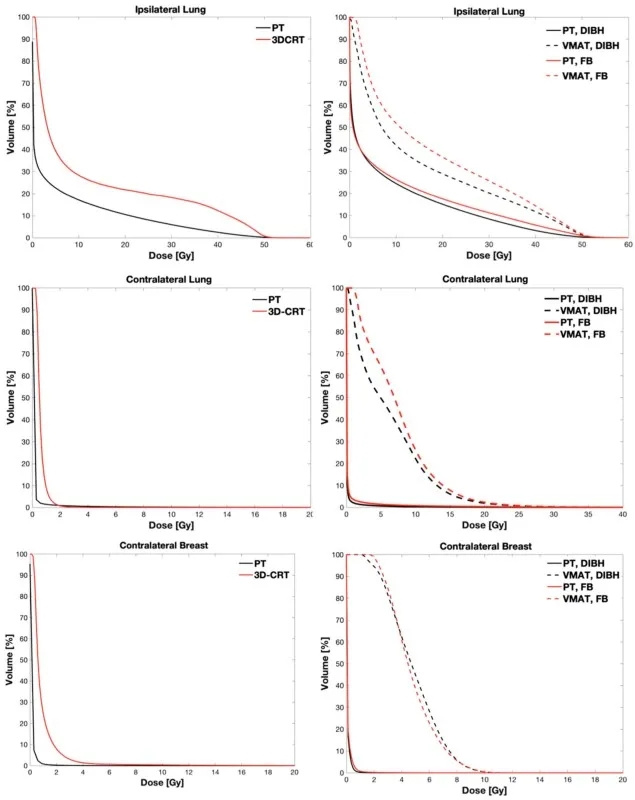
图2. 纳入研究的患者危及器官的累积DVH平均值(左栏第一组,右栏第二组):上排显示同侧肺,中间显示对侧肺,下排显示对侧乳腺。
独立于EAR计算采用的剂量响应模型,可以始终观察到PT与切向3D-CRT相比具有相同的低SCR趋势(见表2)。当进行配对显著性检验时,两种技术之间总是能观察到显著差异。对于PT来说, EAR最大成分来自同侧肺,由于剂量非常低,对侧危及器官的SCR接近零。对于切向3D-CRT,EAR中不可忽视的部分是沉积在对侧肺和乳腺的剂量,线性模型约为10%,线性区和平台模型约为30%。此外,根据线性指数模型和平台模型,PT中包含IMNs的EAR增加了约28%。增加的风险主要是来源于同侧肺成分,而对侧危及器官受影响较小。
表2. 两组患者的平均EAR
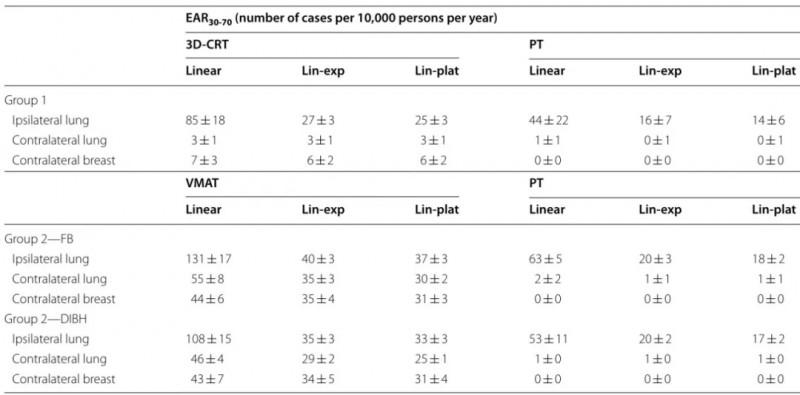
表2还显示,VMAT照射的风险比PT高约5倍。所有成对比较的p值均小于0.01。与PT照射相反,VMAT照射时,由于低、中剂量的扩展分布,每个危及器官对整个EAR的贡献约为1/3。当比较自由呼吸条件下的SCR时,靶区复杂性的影响也很明显。VMAT治疗的第2组患者对侧乳腺的EAR明显更高,其绝对值依赖于剂量反应模型,FB和DIBH之间的差异很小。此外,50岁时接受VMAT治疗的患者对侧乳房SCR比30岁的患者减少了约60%。
本研究假定了一些近似值。首先,EAR估计受到较大的不确定性的影响,这是由于难以确定EAR0系数和它在特定患者群体中的应用。这是SCR估计中已知的的一个问题,但它不影响不同技术之间的相对比较。本研究中进行的EAR评估是基于三种不同剂量反应模型。
相比较于钟型或平台模型,线性模型的应用总是导致较高的EAR。然而,线性模型预计会在剂量高于几个Gy时失效,从而导致对SCR的过高估计。分析中没有包括中子对总剂量的贡献。先前的研究表明,在光子照射处理中,中子剂量的增加可以忽略不计。
对于质子的使用,研究表明笔形束扫描与被动散射技术相比,次级中子的产生显著减少。通过独立MC模拟,结果表明总中子剂量对EAR的估计影响不大。本研究也忽略了CT成像对SCR的影响。此外,变量RBE没有纳入本研究。
RBE变量的影响可能是双重性的:一方面,它可能导致突变率增加,另一方面,它将转化为生物剂量的增加。虽然前者可能与SCR的预期增加有关,后者也将增加细胞失活的可能性,从而降低SCR。在当前的EAR模型中,变量RBE对SCR的影响并没有被明确地考虑在内,这也值得进一步的研究。
结论
该项研究人员表明,接受质子放射治疗对于淋巴结受累的乳腺癌患者是有益的。再加上远端危及器官(如心、肺)的剂量受量较低,乳腺癌患者选择质子治疗具有较高的成本效益,尤其是对于靶区包含IMN时,质子治疗提供的增益最大。在这种情况下,特别是对于年轻乳腺癌患者,质子治疗可能是替代VMAT照射的最佳选择。(质子中国 编辑报道)
参考文献
Cartechini G, Fracchiolla F, Menegotti L, et al. Proton pencil beam scanning reduces secondary cancer risk in breast cancer patients with internal mammary chain involvement compared to photon radiotherapy. Radiat Oncol. 2020;15(1):228. Published 2020 Oct 2. doi:10.1186/s13014-020-01671-8.
文章来源:质子中国







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城