肺癌EGFR-TKI靶向药Nazartinib(纳扎替尼、EGF816)的疗效及安全性
编者按:约半数的晚期非小细胞肺癌(NSCLC)患者接受一代EGFR-TKI治疗失败是由于T790M突变导致的,目前针对这一突变的药物仅有奥希替尼获得批准。近期,Lancet Respiratory Medicine杂志发表了一款新的三代EGFR-TKI——Nazartinib (EGF816)在NSCLC患者中的疗效及安全性的相关研究,笔者进行摘要编译,以飨读者。
研究背景
EGFR突变在高加索和亚裔人群中出现的比例分别为10%~17%和50%,其中90%左右的EGFR突变为19del或21L858R突变。一代/二代TKI类药物是这部分患者有效的治疗选择,但经过中位10~16个月的无进展生存期(PFS)后,患者因耐药而导致治疗失败。其中,50-60%的患者是由于T790M突变导致的。既往体外实验实现,以阿法替尼和达可替尼为代表的二代药物针对T790M突变具有部分活性,但毒性限制了其临床应用。三代TKI类药物可有效阻断T790M突变而对野生型EGFR突变的阻断不明显,已经进入临床应用。AURA3研究发现,携带T790M突变的患者接受奥希替尼的治疗可获得71%的客观缓解率(ORR)和10.1个月的PFS,优于化疗的疗效,因此被批准用于这部分患者的治疗。
Nazartinib (EGF816)是一个新的、突变选择性的TKI类药物,可阻断19del、21L858R及T790M等突变靶点。临床前研究显示,Nazartinib在动物模型中显示了更强的肿瘤退缩能力。本研究报道了Nazartinib在EGFR突变的NSCLC中的疗效及安全性。
研究方法
本研究是一项开放标签的1/2期多中心临床研究,纳入局部晚期或转移性EGFR突变的NSCLC患者。研究包括I期剂量爬坡及II期剂量扩展两个阶段。该研究初始方案的入组标准主要是携带EGFR敏感突变,经过一代/二代EGFR-TKI治疗后耐药且携带T790M突变的患者。经过多次修正后,符合以下任一条入组标准的患者即可入组:携带EGFR敏感突变,未接受EGFR-TKI治疗且化疗不超过1周期;携带20插入或缺失突变,且既往接受≤3种治疗,包括EGFR-TKI治疗;携带EGFR敏感突变,尽管接受一代/二代EGFR-TKI治疗,但不携带T790M突变,患者治疗线数≤3线,且未接受过针对T790M突变的治疗;携带EGFR敏感突变,接受一代/二代EGFR-TKI治疗后进展,且携带T790M突变,患者治疗线数≤3线;三代TKI治疗进展或不可耐受。EGFR突变状态不要求中心实验室确认。患者PS评分0-2分。有不稳定脑转移的患者不能入组。
符合入组标准的患者接受Nazartinib的治疗,治疗剂量从75 mg开始,中间设置100 mg、150 mg、200 mg、225 mg、300 mg及350 mg等7个不同剂量组(药物均为口服)。爬坡持续进行,直至出现最大耐受剂量或到达目标剂量。如果疾病进展后,研究者认为患者可以继续从治疗中获益,允许患者继续接受治疗。患者剂量降低的比例不得超过预期剂量的75%。治疗期间每8周进行一次疗效评估。除根据RECIST判断疾病进展外,基线非靶病灶的恶化同样被认为是疾病进展。
I期的主要研究终点是确定最大耐受剂量及II期推荐治疗剂量,次要研究终点是安全性特征(严重不良反应的发生率及严重性)、耐受性(剂量降低及治疗终止)、研究者评估的疗效(ORR、DCR、PFS及反应持续时间等)。![]()
研究结果
研究共入组180例患者(图1),所有患者均至少接受了1周期的Nazartinib的治疗,不同剂量组具体如下:75 mg (n=17),100 mg (n=38),150 mg (n=73),200 mg (n=8),225 mg (n=28),300 mg (n=5)和350 mg (n=11)。数据截止时,81%的患者终止治疗。
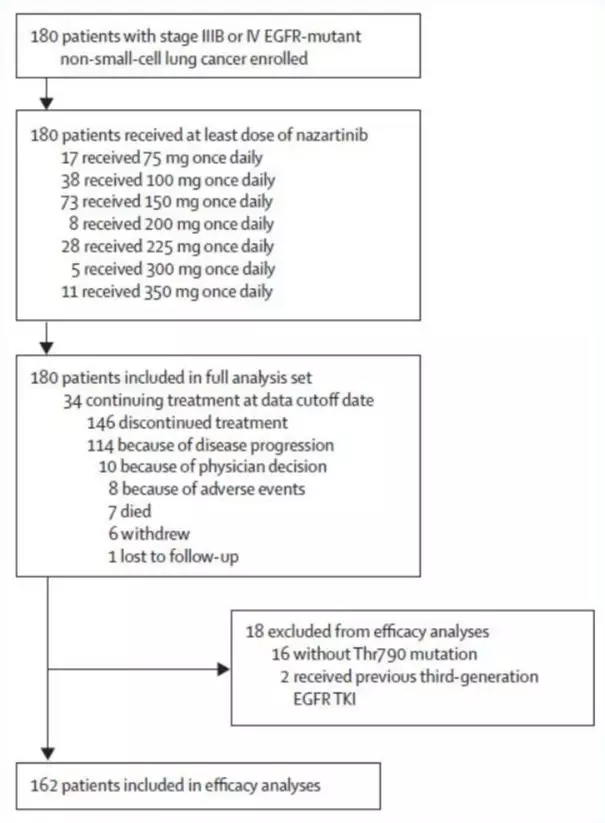
图1. 患者入组流程图
根据患者突变类型及既往治疗线数共分为6类,其中接受一代/二代TKI治疗后出现T790M突变(n=157)或携带原发性T790M突变的患者(n=5)占多数。
患者血药浓度的中位达峰时间为2.5~6.1小时(图2)。不同治疗组的半衰期相似,不依赖于治疗剂量的变化而变化。共计6例患者记录到剂量限制性毒性,2例在150 mg组,1例在225 mg组,3例350 mg组。
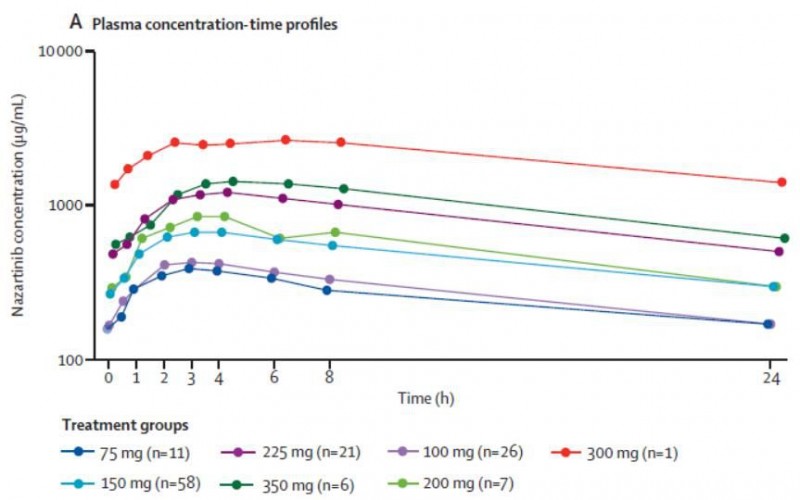
图2. 不同时间及治疗剂量的Nazartinib血药浓度
99%的患者出现了不良事件(任何级别、任何原因导致),其中最常见的不良反应为皮疹(62%),通常在治疗的前2个月内出现。而治疗相关的不良反应发生率为91%(任何级别),最常见的不良反应仍然是皮疹(57%),3度及以上不良反应发生率为27%,相对较为常见的分别为皮疹(15%)、口腔炎(2%)和风团(2%),其余与治疗有关的3度及以上不良反应发生率均小于2%。10%的患者因治疗相关不良反应需要降低剂量,无患者永久性终止治疗。接受Nazartinib治疗过程中,未观察到QTc间期延长或心血管事件。
进行疗效分析时,18例既往接受过三代EGFR-TKI治疗或T790M突变阴性的患者排除入组。整个研究队列的ORR为51%,所有剂量组的患者均观察到CR或PR的发生(图3)。进一步研究发现,携带19del+T790M突变的患者整体ORR为61%,优于21L858R+T790M突变患者35%的比例。
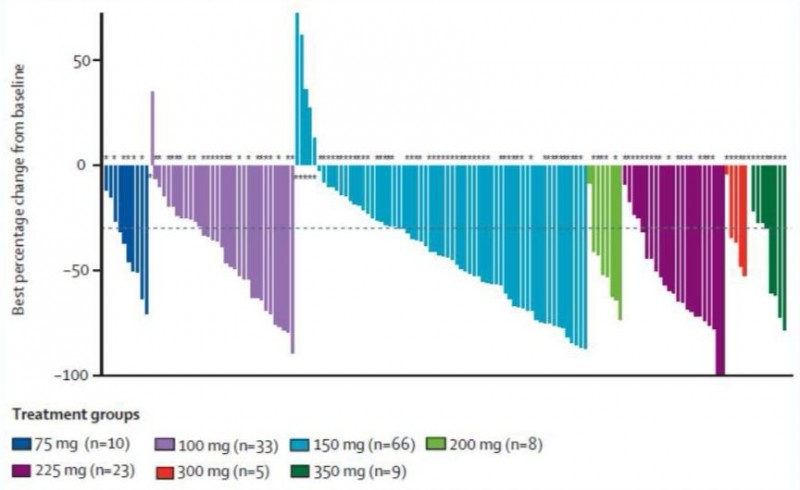
图3. 不同剂量组患者接受治疗的瀑布图
整个研究队列的反应持续时间为11.0个月(95% CI: 9.2–14.7个月),中位PFS为9.1个月(95% CI: 7.3–11.1个月),12个月的PFS率为41%(95% CI: 33–49%),携带19del+T790M及21L858R+20T790M突变患者的中位PFS分别为9.6个月(95% CI: 7.6–12.7个月)和7.2个月(5.4–11.1个月)。
在162例携带T790M突变且既往未接受过三代TKI类药物治疗的患者中,28%的患者基线有脑转移,但98%的患者脑转移病灶被记录为非靶病灶,经过治疗后,16%的患者颅脑病灶影像学上变为不可测量。
该研究中,尽管最大耐受剂量并未出现,但任何级别的皮疹及3度以上皮疹发生率随着治疗剂量的提高而提高,而超过200mg的治疗剂量可导致70%的患者出现皮疹。150mg剂量组显示了良好的耐受性,且患者的ORR达到50%,理论模型预测150mg剂量组可比低剂量组提供更加稳定的血药浓度,基于这些原因,后续治疗Nazartinib的推荐剂量为150mg,片剂,口服,每日一次。在接受该推荐剂量治疗时,7%的患者因皮疹导致剂量降低。
研究结论
Nazartinib有较好的安全性,皮肤毒性发生率相对较低且主要以斑丘样皮疹为主。
文献来源:https://www.thelancet.com/journals/lanres/article/PIIS2213-2600(19)30267-X/fulltext
内容来源:肿瘤瞭望







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城