CAR-T细胞疗法,靶向Claudin18.2(CLDN18.2,CT041)自体CAR-T疗法CT041获加拿大卫生部批准临床试验,更多的CAR-T临床试验招募正在进行中
在过去的十年中,靶向治疗和免疫治疗已经彻底改变了各种癌症的治疗方法。尽管曲妥珠单抗对HER2阳性胃癌患者进行靶向治疗,但生存率一直很低,主要是由于疾病进展和与治疗相关的毒性。活跃发展的一个领域是寻找理想的单克隆抗体(IMAB),从而避免不必要的副作用。基于此,众多研究人员将目光锁定一一个新兴胃癌治疗性靶标——Claudin 18.2,这个靶标的发现也翻开了胃癌靶向治疗的新篇章。
Claudin18.2(CLDN18.2)是Claudin蛋白质家族的一员,位于细胞膜表面,正常情况下仅低水平表达于胃粘膜分化上皮细胞,但在病理状态下,Claudin18.2在多种肿瘤中有的表达显著上调,包括80%的胃肠道腺瘤、60%的胰腺肿瘤。此外,CLDN 18.2活化还可见于食管癌、卵巢癌和肺腺癌中,因此是具有潜力治疗癌症的热门靶点。
基于此,中国研究人员开发了国际上首个针对 Claudin18.2的CAR-T细胞。
又攻下一城!CT041的临床试验申请获加拿大卫生部批准
据美通社报道,11月22日,科济药业自主研发的CT041,一种针对CLDN18.2的自体CAR-T候选产品,已获得加拿大卫生部关于临床试验申请的无异议函,这意味着CT041获批进入加拿大临床试验阶段。

截至公告日,CT041为全球唯一靶向CLDN18.2的、且已获得美国食品药品监督管理局、中国国家药监局和加拿大卫生部IND批准、并正在进行临床试验研究的CAR-T细胞免疫治疗方法。
CAR-T疗法实体瘤又有新突破!国产CT041获欧洲优先药物资格
就在11月15日,CAR-T疗法针对实体瘤领域的进展又迎来喜讯!科济药业公告称,欧洲药品管理局(EMA)已授予自主研发的CAR-T产品CT041优先药物(PRIME)资格。CT041是一种针对 claudin18.2 蛋白 (CLDN18.2) 的自体 CAR T 细胞候选产品,用于治疗胃/胃食管交界处癌 (GC/GEJ)。据悉,入选PRIME有助于缩短药物上市时间。

值得一提的是,这是全球首个获得优先药物资格的实体瘤CAR-T产品。这意味着,CT041有望成为全球首个获批上市的实体瘤CAR-T产品,从而实现CAR-T在实体瘤领域的突破。消息一经传出,二级市场表现较为振奋,截止当日股市收盘,科济药业涨幅5.75%。
晚期胃癌的新希望!国产CAR-T疗法CT041首次亮相ESMO
嵌合抗原受体修饰T细胞(CAR-T)无疑是最令人期待的治疗手段之一。这项技术近年来在治疗各种恶性肿瘤方面取得了巨大进展,已成功应用于多种血液恶性肿瘤的治疗。
但是,全球约90%的癌症病例是实体肿瘤,CAR-T疗法在肝癌、胃癌、胰腺癌等消化系统肿瘤中虽然也取得了一定的疗效,但是少之又少,因此,国内外的学者针对CAR-T进行了多种改造,不断地发现新靶点,以用于治疗多种实体肿瘤。
CT041作为首个针对 Claudin18.2的CAR-T细胞首次亮相于2019年的ASCO年会上,靶向claudin18.2 CAR T细胞治疗的12例转移性腺癌(胃癌7例,胰腺癌5例)患者,均未发生严重不良事件、治疗相关死亡或严重神经毒性。11例评估对象中:1例(胃腺癌)完全缓解;3例(胃腺癌2例胰腺腺癌1例)部分缓解;5例病情稳定;2例病情进展;总客观缓解率为33.3%。
并且,CAR-Claudin18.2 T 细胞治疗胃癌的临床前研究成果显示,靶向Claudin18.2的CAR-T细胞在小鼠模型中可以完全清除胃肿瘤,且没有发生脱靶毒性。
就在9月16~21日召开的欧洲肿瘤内科学会(ESMO)年会上,由科济药业开发的靶向Claudin18.2(CLDN18.2)自体CAR-T候选产品CT041展现了其在消化系统肿瘤中的突出疗效,可谓是大放异彩!
此项研究为中国开展、多中心、开放标签的I期临床试验,截止到2021年4月8日,纳入的37例CLDN18.2表达阳性的晚期消化道肿瘤患者接受CT041输注并完成至少12周的评估。
其中包括28例胃癌/胃食管结合部癌、5例胰腺癌和4例其他类型的实体瘤,28例患者细胞输注剂量为2.5×108CAR-T细胞,6例患者输注3.75×108,3例患者输注5×108 CAR-T细胞。约84%的患者既往接受过至少2线治疗,中位转移器官数量为3个。
研究数据颇为亮眼
1)总疗效:所有患者的客观缓解率达48.6%,疾病控制率达73%;所有胃癌患者总客观缓解率为57.1%。
2)既往接受至少2线治疗失败的胃癌患者:客观缓解率为61.1%,疾病控制率为83.3%。
3)28例胃癌/胃食管结合部癌各亚组:在既往PD-(L)1抑制剂治疗失败、存在腹膜转移、印戒细胞癌等预后差且已无有效治疗手段的患者中,客观缓解率均可维持在50%或以上。
4)安全性:CT041总体耐受性良好,未发生治疗相关死亡或免疫细胞治疗相关神经系统毒性综合征(ICANS)。
典型病例
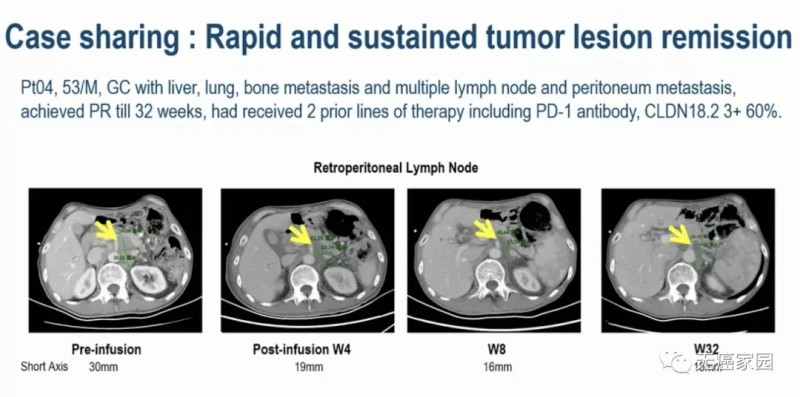
01、04号患者 53岁 男性
来源 CARsgen Therapeutics
晚期胃癌伴肝、肺、骨转移和多发淋巴结和腹膜转移,已接受包括 PD-1 抗体在内的2种全身治疗,CLDN18.2 60%(3+),接受CAR-T治疗后,肿瘤缩小近50%,持续缓解32周。
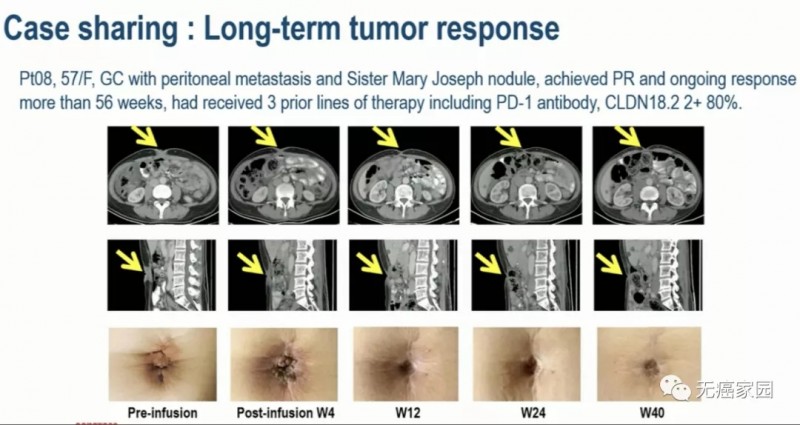
02、08号患者 57岁 女性
来源 CARsgen Therapeutics
GC 有腹膜转移和玛丽约瑟夫结节(恶性肿瘤转移到脐部形成的结节样病变),之前接受过3线疗包括PD-1抗体,CLDN18.2 80%(2+),接受CAR-T治疗后达到部分缓解,并且持续反应超过56周。
目前,无癌家园有多款血液肿瘤及实体瘤的CAR-T临床试验正在进行招募,有意向者可咨询医学部具体评估病情!
图片5
除此之外,还有多款靶向CLDN18.2的CAR-T细胞疗法。例如,由传奇生物研发的LB-1904,用于治疗胃癌或者胰腺癌,目前已经进入临床I期试验。此外,传奇生物还启动了一项靶向Claudin18.2 的CAR-T细胞制剂LCAR-C18S,用于治疗晚期胃腺癌患者,目前也正在进行临床试验招募中。
任重道远,CT041有望为更多实体瘤带来新的希望!未来可期!
作为国际上首个针对 Claudin18.2 的 CAR-T细胞,CT041早在2019年ASCO年会上就崭露头角,当时总客观缓解率为33.3%就已经惊艳世界,如今更加显著的疗效无疑是锦上添花!此次的临床数据展现出对消化系统肿瘤的良好治疗前景!
2020年5月,FDA批准了CT041人源化抗claudin18.2自体嵌合抗原受体CAR-T细胞用于治疗claudin18.2阳性的胃、胃食管连接处或胰腺腺癌患者的研究新药(IND)许可!
CT041为全球唯一获得IND许可的靶向CLDN18.2 CAR-T,在2020年,美国FDA授予其孤儿药认定,用于治疗胃癌/胃食管结合部癌;2021年,CT041获得欧洲药品管理局(EMA)的孤儿药认定,用于治疗胃癌。
截至目前,国内开展的CAR-T临床试验数量已经超过500项,居世界第一,这也是中国首次在一个新药研发领域走到国际前列。其中,传奇生物的西达基奥仑赛、科济药业的Claudin18.2 CAR-T都达到全球领先水平。此外,还有多公司在布局新一代CAR-T以及异体CAR-T技术,初步数据优异,有望获得全球市场。
今年我国迎来了细胞免疫治疗的元年,作为先锋的CAR-T疗法,是未来发展方向之一。CAR-T疗法主要在于改造T细胞来使其识别肿瘤细胞的特殊靶点,理论上,可以有无数种针对不同靶点的CAR-T疗法,这意味着蕴含着无限可能。
希望不久的将来,能够在国内外医学科研工作者的努力下,降低细胞疗法毒副作用,降低价格,突破实体瘤的瓶颈,让越来越多的晚期癌症患者获益!
参考文献
https://www.prnewswire.com/news-releases/carsgen-receives-cta-authorization-from-health-canada-for-cldn18-2-targeted-car-t-cell-product-ct041--301429649.html







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城