2021年8款晚期癌症肿瘤患者抗癌抗肿瘤新药、新疗法瞄准多样癌种,火力全开
近年来,国内癌症的发病数和死亡数持续增加,恶性肿瘤已成为危害中国居民健康的主要原因。据无癌家园报道,我国约有80%的恶性肿瘤患者在发现时已是晚期。此时患者总面临着这样的困惑,是积极治疗,放手一搏?还是放弃治疗,听天由命?答案自然是选择前者!
然而,很多中晚期癌症患者的治疗盲目地进行过多的手术、化疗、放疗,一味地追求消灭肿瘤,企图达到完全康复的目的。但殊不知,中晚期癌症患者由于机体状态本身就差,过度的治疗会严重损伤抵抗力,反而容易反复发作,加速死亡。
无癌家园专家指出,中晚期癌症的治疗不能一味地追求肿瘤的消退,而应该把重点放在控制肿瘤,延长患者的生存期,实现长期“带瘤生存”,争取与肿瘤细胞“和平共处”,使癌症也变成糖尿病、心脏病等普通慢性病一样,才是科学抗癌的正确理念。
患癌后,无论是医生还是患者,都要做好长期打持久战的准备,不能急功近利而过度治疗,结果只能适得其反,欲速则不达!
随着全球对癌症研究的不断深入,越来越多的抗癌新药和新技术问世,足以控制晚期癌症的进展,提高生活质量,延长寿命,甚至让很多生命即将终结的晚期癌症患者奇迹重生!正值2021年年末之际,今年众多抗癌“黑科技”发展势头迅猛,而且都恰巧在国内有临床招募,无癌家园小编今天就迫不及待地给大家介绍这些国际先进前沿新技术新疗法!
抗癌新疗法
嵌合抗原受体(CAR)T细胞疗法
CAR-T细胞疗法就是嵌合抗原受体T细胞免疫疗法,是目前国际最前沿的肿瘤治疗方法,即从人体血液中提取T细胞,应用基因工程技术将其变身为能识别并消灭肿瘤的CAR-T细胞,再将其输入患者体内。
众所周知,CAR-T疗法改变了血液恶性肿瘤治疗图景,成为近年来最具潜力的肿瘤免疫疗法之一。随着四款靶向CD19的自体CAR-T疗法Kymriah和Yescarta、Tecartus、Breyanzi相继获批上市,靶向BCMA的CAR-T疗法Abecma获批上市,CAR-T的显著疗效逐渐获得业内肯定,也变成众多癌友们非常关注的焦点。
1、爆!终于官宣了!国内首款CAR-T疗法获批上市!
我国CAR-T技术虽然起步晚,但国内市场规模大,就在6月22日,我国CAR-T领域的空白终于被打破!
中国国家药品监督管理局(NMPA)最新公示,复星凯特生物科技有限公司(以下简称 “复星凯特”)靶向 CD19 的 CAR-T 细胞治疗产品阿基仑赛注射液(又称阿基仑赛,FKC876)正式获批上市。
这是中国首个获批上市的CAR-T疗法,全球第6款获批上市的CAR-T疗法。相信紧随其后,中国将迎来CAR-T细胞疗法井喷时代。
2、短短1个月,中国第2款、全球第6款CAR-T疗法获批
9月3日,国家药监管理局最新公示,药明巨诺靶向CD19的CAR-T产品瑞基奥仑赛注射液(relma-cel,商品名:倍诺达)已正式获批。瑞基奥仑赛注射液此次获批的适应症为:用于治疗经过二线或以上系统性治疗后成人患者的复发或难治性大B细胞淋巴瘤(r/r LBCL)。瑞基奥仑赛注射液是中国第二款获批的CAR-T产品,也是中国首款1类生物制品的CAR-T产品。

距离上次7月30日提交审批,不过才短短1个月左右,可谓是进展神速,可喜可贺!
2020年6月,瑞基奥仑赛注射液用于弥漫性大B细胞淋巴瘤的三线治疗上市申请获得NMPA受理,并纳入优先审评。
在2020年美国血液学会(ASH)年会公布的数据中,58例可评估有效性的复发或难治性(r/r)大B细胞淋巴瘤患者,3个月的客观缓解率(ORR)为58.6%;客观缓解率(BOR)为75.9%,完全缓解率(CR)为51.7%;中位随访时间为8.9个月,中位总生存期(OS)尚未达到,6个月的OS率为90.8%;6个月缓解持续时间(DOR)为60%;6个月的无进展生存率(PFS)为54.2%。
不良事件方面,3级及以上CRS(细胞因子释放综合征)率达5.1%,NT毒性达5.1%。总的来说,无论从临床疗效抑或安全性的角度,瑞基奥仑赛注射液表现均十分优异。
无癌家园临床招募
目前,无癌家园正在对一款CAR-T细胞疗法进行招募,主要是关于晚期实体瘤的临床研究。
其中涵盖多癌种,包括甲状腺癌、前列腺癌、胰腺癌、肝癌、肺癌、乳腺癌、膀胱癌、食管癌、肾癌、卵巢癌、子宫癌、黑色素瘤、胃癌、滑膜肉瘤、头颈癌。
具体的入排标准可详情咨询无癌家园医学部,会进行详细的医学评估。
3、总缓解率98%!BCMA CAR-T疗法JNJ-4528疗效强劲!
6月1日,国内药企公布了BCMA导向CAR-T细胞疗法JNJ-4528(cilta-cel,LCAR-B38M CAR-T细胞自体回输制剂)的最新研究数据。结果表明,在先前接受过多种疗法(过度预治疗)的复发/难治性多发性骨髓瘤(RRMM)患者中,cilta-cel显示出持续的疗效和持续缓解!
研究结果显示,中位18个月的长期随访,客观缓解率(ORR)达到了98%,80%的患者达到严格的完全缓解(sCR)。在18个月时,有66%的患者存活且疾病无进展。在2021年ASCO大会上公布的结果显示,中位随访18个月,总生存率为81%。
目前有一款针对复发/难治CD4阳性T细胞淋巴瘤和一款靶向CD20复发难治非霍奇金淋巴瘤的CAR-T疗法正在招募中,详细入排标准请咨询无癌家园医学部。
4、疾病控制率达78%,国产CAR-T疗法在肝癌领域大展拳脚
今年ASCO年会上我国医学研究者们首次公布了靶向GPC3的CAR-T药物(Ori-CAR-001)治疗复发/难治性肝细胞癌的最新临床研究数据。该研究的初步数据显示,Ori-CAR-001在GPC3阳性复发/难治性患者中表现出良好安全性和有效性。
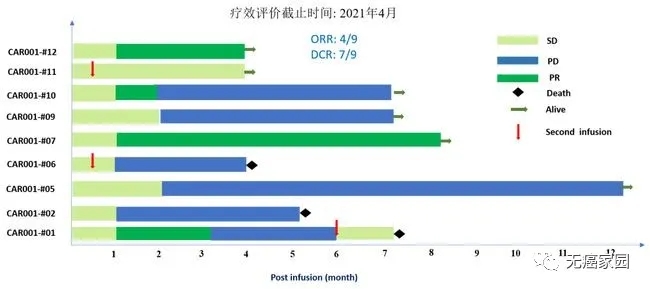
截至2021年3月10日,共纳入11名接受细胞输注的复发受试者。所有受试者均患有晚期肝细胞癌,并且经过化疗、TACE(肝动脉化疗栓塞术)和靶向治疗均无效。9例可评估受试者中,4例达到部分缓解 (PR),3例达到疾病稳定 (SD),2例出现疾病进展 (PD),客观缓解率为44%,疾病控制率达到78%。
5、CAR-T挑战实体瘤!治疗胃癌及胰腺癌的CT041疗效惊艳
Claudin18.2(CLDN18.2)位于细胞膜表面,正常情况下表达于胃粘膜分化上皮细胞,在胃腺癌中表达高达70%。此外,CLDN 18.2活化还可见于胰腺癌、食管癌、卵巢癌和肺癌,因此是具有潜力的CAR-T靶点。
基于此,中国研究人员开发了国际上首个针对 Claudin18.2 的 CAR-T 细胞。
2019 ASCO年会上,CAR-Claudin18.2 T 细胞治疗胃癌/胰腺癌的临床数据更新显示,靶向claudin18.2 CAR T细胞治疗12例转移性腺癌(胃癌7例,胰腺癌5例),未发生严重不良事件、治疗相关死亡或严重神经毒性。11例评估对象中:1例(胃腺癌)完全缓解;3例(胃腺癌2例胰腺腺癌1例)部分缓解;5例病情稳定;2例病情进展;总客观缓解率为33.3%。
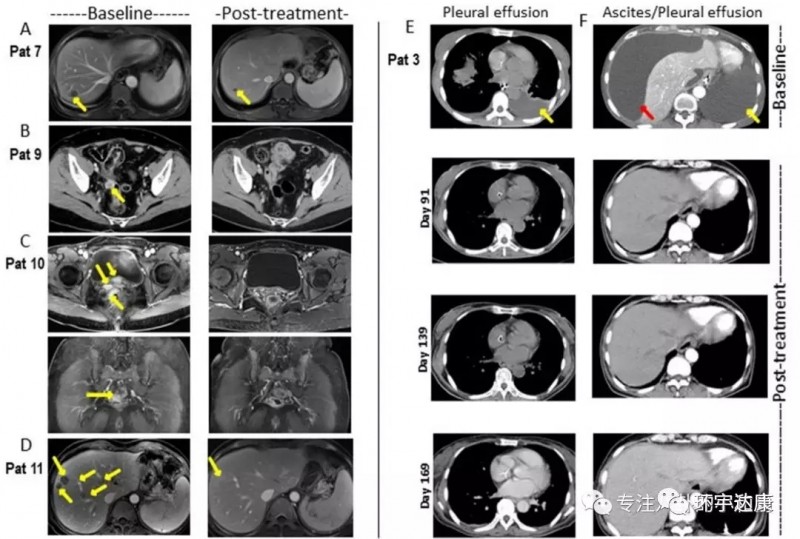
并且,CAR-Claudin18.2 T 细胞治疗胃癌的临床前研究成果显示,靶向Claudin18.2的CAR-T细胞在小鼠模型中可以完全清除胃肿瘤,且没有发生脱靶毒性。
9月16~21日召开的欧洲肿瘤内科学会(ESMO)年会上,由科济药业开发的靶向Claudin18.2(CLDN18.2)自体CAR-T候选产品CT041展现了其在消化系统肿瘤中的突出疗效,可谓是大放异彩!
截止到2021年4月8日,纳入的37例CLDN18.2表达阳性的晚期消化道肿瘤患者,其中包括28例胃癌/胃食管结合部癌、5例胰腺癌和4例其他类型的实体瘤,约84%的患者既往接受过至少2线治疗,中位转移器官数量为3个。
研究数据颇为亮眼
1)总疗效:所有患者的客观缓解率达48.6%,疾病控制率达73%;所有胃癌患者总客观缓解率为57.1%。
2)既往接受至少2线治疗失败的胃癌患者:客观缓解率为61.1%,疾病控制率为83.3%。
3)28例胃癌/胃食管结合部癌各亚组:在既往PD-(L)1抑制剂治疗失败、存在腹膜转移、印戒细胞癌等预后差且已无有效治疗手段的患者中,客观缓解率均可维持在50%或以上。
4)安全性:CT041总体耐受性良好,未发生治疗相关死亡或免疫细胞治疗相关神经系统毒性综合征(ICANS)。
11月15日,CAR-T疗法针对实体瘤领域的进展又迎来喜讯!科济药业公告称,欧洲药品管理局(EMA)已授予自主研发的CAR-T产品CT041优先药物(PRIME)资格。
据美通社报道,11月22日,科济药业自主研发的CT041已获得加拿大卫生部关于临床试验申请的无异议函,这意味着CT041获批进入加拿大临床试验阶段。
截至公告日,CT041为全球唯一靶向CLDN18.2的、且已获得美国食品药品监督管理局、中国国家药监局和加拿大卫生部IND批准、并正在进行临床试验研究的CAR-T细胞免疫治疗方法。
6、无进展生存5个月,生存达17个月!卵巢癌CAR-T疗法成效显著
2月18日,《癌症免疫治疗杂志》刊登了关于中国医学研究者采取CAR-T自分泌PD-1抗体用于实体肿瘤治疗的研究成果。临床数据显示,一名晚期难治性卵巢癌患者采用这种治疗手段后,无进展生存5个月,生存达17个月。
在这项研究中,化疗失败史的卵巢癌患者接受了与阿帕替尼组合的两次αPD-1-mesoCAR-T细胞输注。MRI观察到肝转移结节的协同抑制作用。该患者获得部分缓解,生存了17个月,并有轻微的副作用。结果表明,CAR-T细胞与阿帕替尼的组合将成为治疗晚期/难治性卵巢癌的新治疗方法。
目前,无癌家园有多款血液肿瘤及实体瘤的CAR-T的临床试验正在进行招募,有意向者可咨询医学部具体评估病情!
电场疗法
戴个“头套”,通上电就能治疗癌症,你可能会嗤之以鼻,别开玩笑了!这岂不是天方夜谭?当然不是!这就是黑科技“肿瘤电场疗法”的治疗手段!
其实通俗点来讲,电场疗法是一种基于生物电作用的物理疗法。这种疗法是利用交替的低强度电场,摧毁肿瘤细胞,同时减少健康组织损伤,可很好地避免副作用影响患者生活质量。

▲TTFields治疗技术源自于Novocure创始人Yoram Palti博士(图片来源:Novocure)
电场疗法自问世以来就得到了医疗界的广泛关注,不仅是因为其原理前所未闻,还因为这样一种天方夜谭般的技术并不是大忽悠,而是凭着一轮又一轮真实有效的振奋人心的临床试验有效率,获得了美国FDA的批准进入临床应用。
2011年,FDA批准电场疗法用于复发的胶质母细胞瘤;
2016年,FDA批准电场疗法用于新诊断的胶质母细胞瘤;
2019年,FDA批准电场疗法用于间皮瘤。
目前,这一抗癌黑科技有望在更有前景的市场中取得突破。2020年5月,美国抗癌黑科技肿瘤电场疗法-Optune正式登录中国,获得我国药监局批准用于治疗组织学证实的复发性多形性胶质母细胞瘤(GBM)的成年患者(22岁或以上),以及与替莫唑胺联合治疗新诊断胶质母细胞瘤。同时,它也有了自己掷地有声的中文大名--爱普盾!

这款疗法之所以被喻为抗癌黑科技,是因为它的原理有别于所有传统的治疗模式,包括手术、药物治疗、放射治疗。
就在2021年7月1日,Novocure公司宣布,其肿瘤电场疗法联合索拉非尼,在治疗肝癌患者2期临床试验HEPANOVA中获得了积极结果。

值得一提的是,此次所选的晚期肝细胞癌患者均是临床上极为难治的类型,52%的患者伴有严重肝功能不全,甚至还有22%的患者预计生存期不足3个月。
试验结果表明,在21例可评估的预后不良患者中,疾病控制率为76%(历史对照组为43%~52%),客观缓解率为9.5%;
在完成至少12周肿瘤电场疗法治疗的患者中,疾病控制率为91%,客观缓解率为18%,均高于历史对照组。
下一步,Novocure计划开展一项关键性3期试验,探索在肝癌患者中,肿瘤电场疗法联合标准治疗(包括免疫疗法)的疗效。
迄今为止,电场疗法已被FDA批准用于治疗复发性胶质母细胞瘤、新诊断的胶质母细胞瘤以及恶性胸膜间皮瘤,并且在目前在六大实体肿瘤包括非小细胞肺癌、非小细胞肺癌脑转移、肝癌、胰腺癌、卵巢癌、乳腺癌的临床试验中都取得了惊人的数据,由于其原理是靶向杀灭所有快速有丝分裂的癌细胞,因此理论上适用于所有实体肿瘤。
目前,电场治疗仪同步在全国14个城市开启首批临床应用(可联系无癌家园医学部进行评估),这标志着15年来中国内地首个胶质母细胞瘤突破性创新疗法正式惠及患者,我们期待这款疗法能在实体肿瘤中取得更多的突破,有更多的实体肿瘤适应症上市,同时希望这款疗法在国内能尽快纳入医保,让更多国内的患者能接受这款“天价”疗法的治疗。
肿瘤浸润淋巴细胞(TILs)治疗
TILs疗法,简单点讲就是将手术切除的肿瘤组织中的淋巴细胞分离纯化,挑选出其中能特异性抗癌的淋巴细胞,扩增活化后回输。这类疗法拥有30多年的历史,最早用于恶性黑色素瘤,近年来在宫颈癌、肺癌等多种实体瘤中都给出了不俗的数据。
01、首个实体瘤细胞免疫疗法获FDA突破性疗法称号
2019年6月,FDA批准肿瘤浸润淋巴细胞(TIL)治疗方法LN-145为突破性的治疗指定,这是用于实体瘤的细胞免疫疗法首次获此殊荣,相信距离上市也仅是时间问题,一旦FDA批准,这将是首款用于实体瘤的细胞免疫疗法,将给癌症患者带来巨大的生存获益。
02、疾病控制率80.3%,随访时间延长至28.1个月,TILs疗法有望上市
就在2021年AACR会议上报道了自体肿瘤浸润淋巴细胞在经预处理的晚期黑色素瘤中能够产生持久的反应,即基于TILs细胞的创新型疗法LN-144(Lifileucel)表现出积极的客观缓解率,对晚期黑素瘤患者进行了28.1个月的随访后,其中位反应持续时间尚未达到。此结果一经发出,再次引起轰动!
TILs免疫疗法招募
目前无癌家园有一款TILs免疫细胞临床试验正在招募中,主要治疗恶性实体肿瘤(包括肺癌、食道癌、卵巢癌、宫颈癌、乳腺癌、胆道癌)等癌种。若想参加请咨询无癌家园医学部,详细评估病情。
抗癌新药
2021年国内外的抗癌新药犹如井喷般涌现,覆盖十大癌种多款抗癌新药,其中包括靶向、免疫检查点抑制剂、过继性细胞免疫疗法等。庆幸的是,KRAS和EGFR20ins两大难治性靶点打破了治疗僵局,迎来了首款靶向药物,又有很多幸运的病友们等来了新的希望和治疗选择。
首款KRAS靶向药:AMG510
KRAS是实体瘤中最常见的癌基因之一,大约30%的肿瘤都存在KRAS突变,包括90%的胰腺癌,30%~40%的结肠癌和15%~20%的肺癌。然而,KRAS靶向药却寥寥无几,KRAS一度成为无药可用的最难突变。
经过数十年几乎不成功的研发,Sotorasib(AMG510)终于在2013年被研发成功,成为首个进入临床试验的KRAS抑制剂。
就在不久前,5月28日,FDA批准Lumakras (sotorasib)用于治疗携带KRAS G12C突变且至少接受过一次全身性治疗的非小细胞肺癌(NSCLC)患者。这是目前唯一一款获得批准用于KRAS突变的靶向药,也称为科学人员突破KRAS“不可成药”的里程碑!
Lumakras的获批,使得非小细胞肺癌靶向精准治疗又向前迈进一大步!
01、用不到AMG510怎么办?国药D-1553崛起,国内患者有救了
鉴于AMG510刚刚获批上市,国人还处于一药难求的迫切阶段,我国的药企也加大了关于KRAS靶点的新药研发进程。
好消息是,针对KRAS g12c突变的各类实体瘤患者,一款国产新药物——D-1553已经正式开始招募患者了!希望参加的患者可以咨询无癌家园医学部了解该试验。
中国首款MET靶向药:赛沃替尼
MET 14外显子跳跃突变在非小细胞肺癌(NSCLC)的发生率为1%~3%,在肺肉瘤样癌(PSC)中的突变率却高达31.8%。MET 14外显子跳跃突变NSCLC对铂类为基础的化疗耐药率较高,因此患者预后也较差。赛沃替尼是中国自主原创的高度选择性口服MET抑制剂,一直有望成为我国首款MET靶向药。没想到这一天终于来临了!
就在6月22日晚间,中国国家药品监督管理局(NMPA)官网显示,和黄医药研发的小分子MET抑制剂赛沃替尼(savolitinib,曾用名:沃利替尼)已在中国获批,这意味着中国迎来了首款获批的选择性MET抑制剂,这也是全球获批的第3款MET抑制剂。
赛沃替尼的此次获批的适应症为间质-上皮转化因子(MET)外显子14跳变的局部晚期或转移性的非小细胞肺癌。


不限癌种实体瘤新药:多斯塔利单抗
2021年8月18日,FDA加速批准了多斯塔利单抗(Dostarlimab-gxly,Jemperli,中文为暂译名)的适应症,用于治疗错配修复缺陷(dMMR)的复发或晚期实体瘤成年患者。患者应当已经接受过现有的标准方案治疗,且没有其它疗效更好的替代选择。
作为批准的依据,Ⅰ期GARNET试验验证了多斯塔利单抗治疗实体瘤、子宫内膜癌以及其它非子宫内膜癌患者的疗效。
结果显示,在dMMR的实体瘤患者中多斯塔利单抗取得了41.6%的出色缓解率,其中包括了超过9%的完全缓解率;除此以外,超过95.4%的患者缓解持续了半年以上,中位缓解持续时间长达34.7个月,接近3年!
作为一款PD-1抑制剂,多斯塔利单抗的落地必定会为大量患者带来新的希望。而同类药物派姆单抗与这款药物的先后成功,也为其他PD-1抑制剂提供了良好的先例,未来一定会有更多重磅新药上市。
针对17种癌症有效!"传奇"抗癌药拉罗替尼招募来袭
2018年11月26日,整个医疗界和癌友圈都为一款FDA新批准上市的抗癌药物沸腾,这就是全球首个不区分肿瘤来源用于初始治疗的靶向药--Vitrakvi ®(拉罗替尼,larotrectinib),用于成人和小儿具有神经营养受体酪氨酸激酶(NTRK)基因融合的实体瘤治疗。
这在肿瘤治疗史上是一个振奋人心的里程碑。
此外,多项临床数据已经证实拉罗替尼对17种实体肿瘤有效,其中常见的肺癌的客观缓解率75%,甲状腺癌和纤维肉瘤高达100%!
今年5月20日,CDE官网显示,拜耳在国内递交硫酸 Larotrectinib 胶囊上市申请并获受理(受理号:JXHS2101015)。这意味着,全球首款不区分肿瘤来源的泛癌种靶向药有望在国内获批,相信在不远的将来,国内的癌症患者会迎来这款“治愈系”抗癌药。

除了多斯塔利单抗及拉罗替尼外,还有用于治疗NTRK融合基因实体瘤的恩曲替尼、TPX-0005、AB-106等也属于广谱抗癌药。目前全球对于NTRK药物的研发正在如火如荼地进行中,以期给更多患者带来新希望!
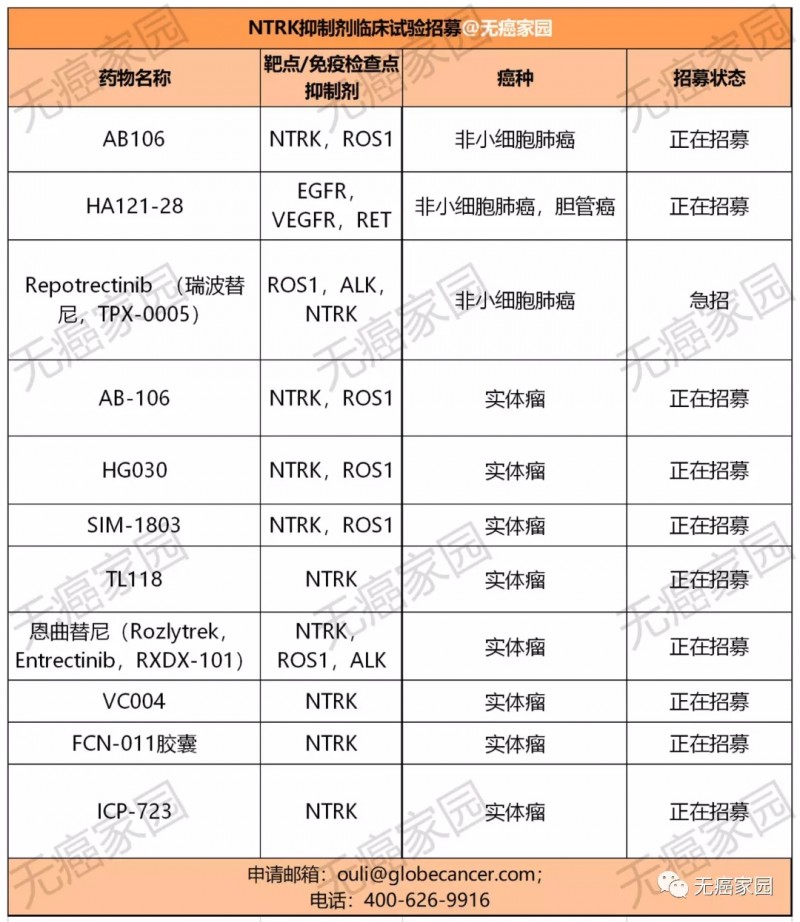
我国自主研发广谱新药:JMT-101
2021年5月22日,FDA宣布批准Amivantamab-vmjw(Rybrevant,JNJ-6372)上市,作为首款获批应用于EGFR外显子20插入突变(ex20ins)的非小细胞肺癌成年或者的治疗方案。
2019年,我国自主研发的、专门针对EGFR ex20in患者的新药JMT-101已经获得批准投入临床试验!并且在2020年ASCO线上会议中,首次公布了这款药物治疗晚期结直肠癌患者的试验结果,疾病控制率达到100%,引起轰动。
好消息是,目前JMT-101治疗多种实体瘤的II期临床试验已经陆续开始。其中,治疗非小细胞肺癌的II期试验正在招募患者,若想参加临床试验请咨询无癌家园医学部。
除了上面介绍的新药,目前多款国内和国外明星新药正在招募,这意味着,国内的病友们也有机会免费接受这些抗癌好药的治疗。
小编有话说
能够有效地对抗实体肿瘤,不伤害正常的细胞,这些在过去只是美好的愿望,如今,一款又一款在过去看来魔幻,天方夜谭的疗法都照进了现实,肿瘤治疗领域的发展日新月异,肿瘤精准诊疗未来可期,相信病友们将迎来更好的未来。







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城