个性化癌症疫苗,多款个性化抗癌抗肿瘤疫苗异军突起
癌症一直是长期困扰人类的疾病之一,然而人们并没有被此打败。疫苗无疑是人类与疾病斗争最具里程碑意义的发明之一,同样的在癌症的治疗过程中,疫苗也发挥了举足轻重的作用!
其实面对长期困扰人类的癌症,人们始终都在不断地探索和钻研,展望着将来什么时候癌症能够被疫苗所终结!事实上,人类一直都从未放弃对癌症疫苗的研究。随着医学的进步,个性化疫苗已成为精准医疗的目标之一,被全球的生物医药公司争相研究,希望能够通过激活人体自身免疫细胞,来达到杀灭癌细胞的目的!
就在不久之前,一种个性化的辅助新抗原肽疫苗 PGV-001已成功合成,并用于治疗疾病复发率超过30%的多种恶性肿瘤患者。
新款癌症疫苗势头强劲,4名患者无癌生存925天
与传统的癌症疫苗不同,个性化的癌症疫苗(PGV-001)是一款专门用于标准治疗后的辅助性治疗疫苗,有助于清除体内残存的癌细胞,延长患者的生存期。
为了探究癌症疫苗的安全性,在2021年AACR年会期间提交的试验中,13名患者接受了PGV-001;其中包括10名实体瘤(6名头颈癌患者,2名非小细胞肺癌患者、1名尿路上皮癌患者、1名乳腺癌患者)和3名多发性骨髓瘤患者。

令人惊喜的是,在实际治疗中,患者接受癌症疫苗的整体耐受性良好,在平均随访925天后,4名患者仍然无癌生存,同也有4名患者在继续接治疗。仅有1/3的患者出现轻微的注射部位反应,整体治疗效果十分不错!
1期试验的主要目标是确定实验治疗的安全性,该试验已实现这一目标。研究人员还看到,对其中一名患者的血液测试显示出该疫苗的免疫反应后,该疫苗具有早期潜在的益处,而其他两名患者其后对免疫疗法的反应也很强,这一结果在接触癌症疫苗后是正常的。
自该试验完成以来,西奈山已开始或计划进行其他五项1期试验,这些试验将OpenVax(西奈山的计算管道,它使研究人员能够识别并确定免疫原性靶标的优先级,以合成并整合到疫苗中。)与其他疗法一起治疗包括胶质母细胞瘤、膀胱癌、前列腺癌和骨髓增生性肿瘤(血癌)在内的其他癌症。
目前这款癌症疫苗还处于早期的临床试验阶段。此外,还有一些国家的树突细胞疫苗已经正式进入临床应用,一些早期肿瘤患者可以在手术后考虑使用疫苗联合放化疗辅助治疗,起到杀伤残余癌细胞,产生免疫记忆、预防癌症复发和转移。
肿瘤新抗原是什么?肿瘤免疫治疗的新突破
刚才我们前文提到的PGV-001就是一款个性化新抗原疫苗。无癌家园小编这里就要科普一个爆款的免疫治疗新概念:Neoantigen(新抗原)。众所周知,癌细胞是从正常细胞癌变而来,本来就属于人体内的一份子,只是经不起“糖衣炮弹”的诱惑,腐化堕落了,会潜伏在人体内“伪装”成正常细胞,千方百计误导防御机制,如果成功躲过防御机制的追击,癌细胞就会在正常组织上扎根,经过漫长的发展时间后,最终形成癌症。
然而正常细胞要癌变,必须要积累足够多的致癌突变,由这些致癌突变制造产生的癌蛋白,为癌细胞所特有,而并不存在于正常细胞上。而肿瘤新抗原是由癌细胞基因突变产生的特异性抗原,在正常细胞中不表达,可激活CD4+T和CD8+T细胞产生免疫反应,抑制肿瘤生长;其免疫原性高、抗肿瘤免疫持续时间长、不易耐受;其靶点是肿瘤特异性抗原(tumor specific antigen,TSA),只杀伤癌细胞,是一种个体化精准细胞免疫治疗。
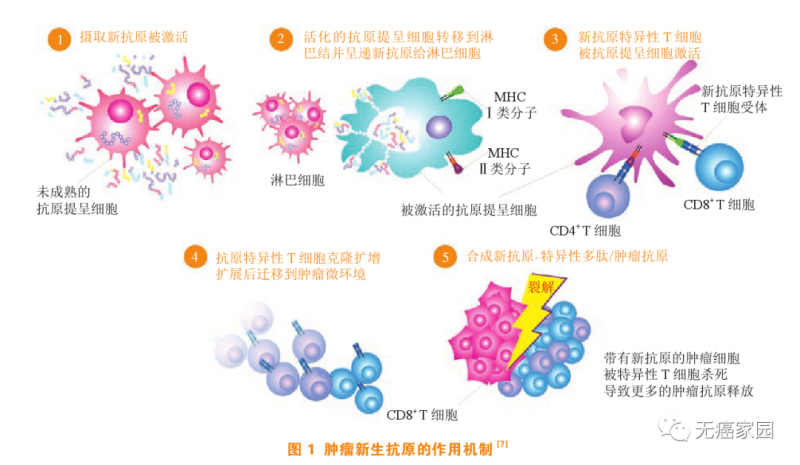
图源《肿瘤新生抗原疫苗研究新进展》
设计肿瘤疫苗最关键的步骤是要找到正确的抗原。肿瘤抗原在传统上分为肿瘤相关抗原 (TAA) 和肿瘤特异性抗原 (TSA) 。肿瘤相关抗原是一类同时表达在肿瘤细胞和正常细胞表面的抗原。由于生长的需要,肿瘤细胞可能会在其表面过度表达某些抗原,这种表达水平的差异就会给患者一定的“治疗空间”。因此通过识别并攻击这类抗原也可以达到“多杀敌,少伤己”的效果。
而肿瘤特异性抗原顾名思义是正常细胞不存在的,肿瘤细胞特有的一些抗原,通过免疫应答可以精准地杀伤肿瘤微环境中的癌细胞而不会产生误伤正常细胞的副作用。因此,这类抗原应该是肿瘤免疫治疗最理想的靶点。
癌症疫苗是一种主动免疫疗法,是肿瘤免疫疗法领域的重要组成部分,通过刺激或恢复人体自身的免疫系统,来防止癌症发展或杀灭现有的肿瘤 。癌症疫苗主要包括细胞疫苗、DNA 疫苗、mRNA 疫苗、多肽疫苗、树突状细胞疫苗、纳米疫苗等。
除了HPV疫苗是知名的预防性癌症疫苗外,Provenge(sipuleucel-T)是FDA批准的唯一一种由患者自身免疫细胞制成的前列腺癌免疫疗法,自此开创了肿瘤免疫治疗的新时代。
新抗原疫苗最大优势:根据患者肿瘤组织突变抗原"量身定制"
个体化新抗原疫苗以基因测序为基础,针对每位患者不同突变位点的、包含多个位点的、个体化的“高级定制”疫苗。
与传统疫苗相比,个体化新抗原疫苗最大的优势是,传统疫苗受HLA(人类白细胞抗原)和抗原表达的双重限制,适用疫苗的患者受限;而个体化新抗原疫苗是针对每位患者肿瘤组织突变抗原“量身定制”的疫苗,即使仍受患者HLA限制性的一定影响,但能保证每位患者有其特定疫苗,最大限度纳入肿瘤患者。其能够激发自体免疫系统对肿瘤细胞进行攻击,能够让更多的患者通过个体化的治疗长期获益。
若想咨询肿瘤新抗原疫苗的最新进展了解治疗事宜,癌友们可将病理报告及治疗经历、出院小结等资料提交至无癌家园医学部,详细评估病情。
新生抗原癌症疫苗制备的4个基本步骤是获取肿瘤组织和正常细胞、推定新肿瘤抗原、确定新表位和制备疫苗。随着新生抗原筛选技术的日趋成熟,已经有多种新生抗原疫苗进入了临床试验阶段,在已经开展的个体化新生抗原疫苗临床试验中,涉及实体肿瘤的超过40种,包括黑色素瘤、脑胶质瘤、肺癌、膀胱癌、胰腺癌、肝癌、卵巢癌等。
接下来无癌家园小编就给各位癌友介绍部分肿瘤新抗原疫苗的研究进展,以供参考!
非小细胞肺癌:DCVAC/LuCa疫苗
DCVAC/LuCa是由美国研发的针对非小细胞肺癌患者的树突状细胞疫苗。通过将树突状细胞与裂解死亡后的患者自体肺癌细胞所释放的抗原物质融合,使树突状细胞获得识别肺癌细胞的能力,并经过体外扩增后回输入患者体内进行治疗。
在2019年ASCO大会上公布的一项冲击晚期肺癌一线治疗方案的研究中,研究者选取了来自12个研究中心的112例患者。
结果显示
●中位总生存期
DCVAC/LuCa联合化疗组为15.5个月,单纯化疗组为11.8个月。
●中位无进展生存期
DCVAC/LuCa联合化疗组为6.74个月,单纯化疗组为5.63个月。
●客观缓解率
DCVAC/LuCa联合化疗组为45%,单纯化疗组位34%。
整体来说,DCVAC/LuCa将IV期非小细胞肺癌患者的死亡风险降低了足有46%!这一研究结果为树突状细胞疫苗治疗非小细胞肺癌的疗效提供了证据。研究者认为,在一线标准化疗方案的基础上联合树突细胞疗法DCVAC/LuCa,疗效确切。
近期再次传来喜讯,值得中国的病友们振奋!
这款美国的前瞻疗法目前已经在国内知名的癌症中心-上海市胸科医院进行了 II 期临床研究,探索新型树突细胞疫苗DCVAC/LuCa(肺癌树突状细胞疫苗)联合标准卡铂/培美曲塞治疗晚期非鳞状细胞 (nsq) 非小细胞肺的安全性和有效性。
研究结果令人振奋
纳入了61名患者,在改良意向治疗人群(44名)中,1年生存率为72.73%,2 年生存率为 52.57%。截止数据发表时,还未达到中位总生存期。中位无进展生存期为8.0个月,客观缓解率为31.82%。
44名患者中,有14名(31.82%)获得部分缓解(PR),30名(68.18%)获得病情稳定(SD)。
因此可以证实,树突细胞疫苗DCVAC/LuCa联合培美曲塞和卡铂在没有致癌驱动因素的初治 IV 期 nsq NSCLC 患者的治疗中,显示出良好的耐受性并显示出有希望的疗效,没有出现严重或意外的不良反应,表明在选定的中国人群中是安全可行的。
乳腺癌:PGP2疫苗
在2020年圣东安尼奥乳腺癌专题讨论会(SABCS)上展示了一张5年随访乳腺癌患者的结果图,顿时火遍整个癌友圈。这款被称为GP2的肿瘤疫苗,以一骑绝尘之势引起极大的轰动,5年随访,乳腺癌复发率为0%,让我们看到了肿瘤临床治愈的曙光!
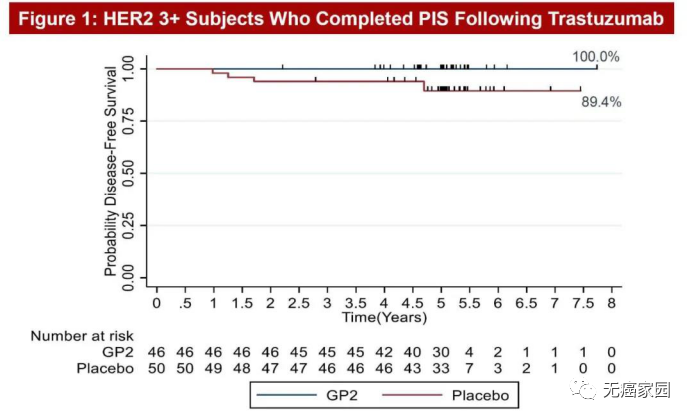
图中非常直观地能够看到,在5年随访后,46例HER2+患者接受GP2+GM-CSF(粒细胞-巨噬细胞集落刺激因子,FDA批准的免疫佐剂)治疗后,5年无病生存率(DFS)为100%,无一例复发!而单纯接受GM-CSF治疗的50例安慰剂患者的5年DFS发生率为89.4%。
GP2疫苗在无严重不良事件的情况下表现出良好的耐受性,并通过局部皮肤试验和免疫试验获得了强有力的免疫应答。
目前,全球已启动多项ARX788的临床研究,其中一项针对既往接受过赫赛汀等一线治疗方案失败的HER2阳性乳腺癌患者的临床研究正在招募患者,有意向参加的癌友可联系无癌家园医学部进行初步评估。
胶质母细胞瘤:AV-GBM-1疫苗
据国外研究报道,原发性胶质母细胞瘤患者的标准治疗方法与不良的预后有关。研究人员推测,使用针对患者的疫苗进行辅助治疗可以通过增强免疫反应来帮助改善患者的预后。
2021年6月8日,国外知名生物医学公司宣布其个性化癌症疫苗AV-GBM-1的II期临床试验数据公布,研究显示此款新型疫苗对延长新诊断的胶质母细胞瘤患者的中期总体生存期展现出极大的潜力。
该试验纳入的57例患者在6个月内接受8剂AV-GBM-1疫苗,在分析时,存活患者已完成治疗,并在入组后10.1~27.6个月内进行随访,中位无进展生存期为10.4个月,与具有里程碑意义的STUPP研究中的中位无进展生存期6.9个月相比,提高了约50%,为新诊断的胶质母细胞瘤患者建立了护理标准。
这表明在6.9个月时进展或死亡的风险降低了42%。中位生存期尚未达到,将在最终患者至少随访15个月后进行评估。
总体而言,患者的治疗耐受性良好,发生的所有不良事件均与疫苗无关。
黑色素瘤:通用型癌症疫苗UV1
2021年10月21日,FDA已批准通用癌症疫苗 UV1 与检查点抑制剂联合用于不可切除或转移性黑色素瘤患者的快速通道指定,作为PD-1单抗派姆单抗(K药,pembrolizumab)或CTLA-4单抗伊匹单抗(ipilimumab)的附加疗法。
研究结果
FDA的决定基于两项UV1联合检查点抑制剂的I期临床试验数据:
在10月13日公布的数据中,UV1 联合 pembrolizumab 作为晚期黑色素瘤的一线治疗被证明是安全的,早期疗效数据很有希望!
1. 客观缓解率 (ORR) 为57%,其中30%的患者达到完全缓解 (CR) 或肿瘤完全消失。
2. 在24个月的随访中,80%的患者存活。如前所述,这些患者的中位无进展生存期为18.9个月。
3. 24个月的随访数据与早期的单独 pembrolizumab大规模研究相比具有优势,后者显示24 个月后的总生存率为58%,中位无进展生存率为 5.5~11.6个月。
在第二个队列中,90%的患者在一年后仍然存活,且肿瘤进展程度相似。
2021年5月发表在免疫学前沿的同行评审数据证明,UV1联合ipilimumab治疗晚期黑色素瘤安全且长期疗效显著,客观缓解率(ORR)为33%,5年总生存率(OS)达到50%。
目前,UV1联合检查点抑制剂正在进行四项II期临床试验,治疗不可切除或转移性黑色素瘤、卵巢癌、头颈部鳞状细胞癌和恶性胸膜间皮瘤。
头颈癌:mRNA-4157疫苗
接下来介绍的这款疫苗就是前段时间在医疗圈刷屏的新型个体化癌症疫苗mRNA-4157,最新公布的一期临床试验数据非常让人振奋,对恶性肿瘤的疾病控制率高达90%,超过了很多已上市的靶向和免疫治疗药物,值得期待。
2020年11月11日,Moderna公司公布了mRNA-4157联合Keytruda能够缩小多种晚期实体肿瘤病灶。
在10例HPV阴性的头颈部鳞状细胞癌患者中,总缓解率为50%:2例完全缓解和3例部分缓解。同时,4例患者疾病稳定,疾病控制率(DCR)达到90%。
与单独使用PD-1抑制剂相比,它具有明显的优势:中位无进展生存期(mPFS)为9.8个月。
即使与Keytruda / chemo组合(一线治疗的标准护理)相比,结果也令人满意,该组合产生的总缓解率为36%,中位无进展生存期为4.9个月。
肾癌:ilixadencel疫苗
ilixadencel(伊利沙定)是一款同种异体树突状细胞(DC)疫苗。根据最新的全球性II期MERECA临床试验(NCT02432846)数据显示,ilixadencel联合靶向抗癌药舒尼替尼(索坦,通用名:sunitinib)一线治疗新诊断的晚期转移性肾细胞癌(mRCC)患者,与单独采用舒尼替尼治疗的患者相比,总缓解率提高一倍,完全缓解率更高,缓解更加持久!
截至2020年8月的最新数据
(1) ilixadencel组的中位总生存期尚未达到,对照组的中位生存期为25.3个月。
(2) ilixadencel组的存活患者比例为43%(24/56),而对照组为33%(10/30)。在此次随访中,ilixadencel组的5例完全缓解者(CR)仍然存活,正如先前报道的,对照组中的1例完全缓解者在第一次随访期间死亡。
2020年5月,美国食品和药物管理局(FDA)授予了ilixadencel再生医学先进疗法(RMAT)资格。
无癌家园专家进一步分析道,ilixadencel联合舒尼替尼一线治疗晚期肾癌,可以大大提高治疗的有效率,患者的总生存率和完全缓解率,并且更加安全。这款新型的疫苗潜力无限,共针对六种癌症类型,包括肾癌、肝癌、胃肠道间质瘤、头颈部肿瘤、非小细胞肺癌和胃癌等实体肿瘤,我们期待进一步的临床数据,希望这款疫苗能早日上市造福患者。
卵巢癌:DCVAC/OvCa疫苗
DCVAC树突疫苗是一种活性细胞免疫治疗,其使用自身树突细胞为每个患者生产和定制,试图诱导针对肿瘤抗原的免疫反应。
在2019年第50届妇科肿瘤学会(SGO)年会上,一项二期临床试验SOV02最终结果公布:对复发,铂敏感,上皮卵巢癌患者使用基于树突状细胞的免疫疗法DCVAC/OvCa添加到标准卡铂和吉西他滨方案,可以使晚期复发的卵巢癌患者总生存期(OS)延长一年多。而且DCVAC/OvCa将卵巢癌二线治疗的死亡风险降低了62%。总生存期(OS)显着增加13.4个月。中位数无进展生存率(mPFS)增加了1.8个月。即将开展全球III期研究。
更让人惊喜的是,这款疫苗让一名患者奇迹般地获得了康复。这名患者46岁,罹患IV期卵巢癌,一般而言,这类患者的预后非常差。之前,她已经接受了5轮化疗,但无济于事。也许是抱着死马当活马医的态度,她接受了抗癌疫苗的治疗,并在2年时间里使用了28次个体化抗癌疫苗。在治疗期间,她的癌症得到了很好的控制。而在停止治疗后,她已经5年没有复发,也就是“临床治愈”!
肿瘤新抗原疫苗前景无限,未来可期
肿瘤治疗性疫苗历经多年发展,其出现称得上是肿瘤治疗领域的一次革命。而新抗原将掀开肿瘤个性化免疫治疗的新篇章,使得患者的免疫细胞如T细胞能够像导弹一样自主追踪和精准攻击肿瘤细胞。多肽疫苗、树突细胞疫苗、mRNA疫苗等不同路径的尝试,已经在恶性黑色素瘤、肺癌、脑胶质瘤等肿瘤治疗领域取得了一定的临床疗效,展示了良好的应用前景(见下图)。
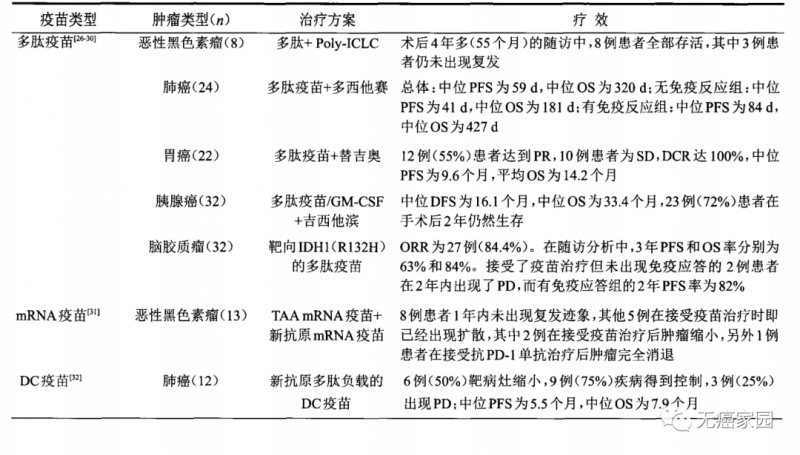
代表性的新抗原肿瘤疫苗临床研究
截至2021年12月31日,在国际临床试验注册平台(http:www.clinicaltrials.gov)上注册的新抗原疫苗相关的临床试验共90项。其中,美国49项居首位,中国24项位列第二。在适应证方面,主要集中在突变负荷较高的恶性黑色素瘤(12%)、肺癌(9%)等实体瘤类型中。在疫苗类型方面,一半以上(47项)的临床试验采用的是多肽/蛋白疫苗,其次是树突细胞疫苗(20项)和核酸疫苗(DNA疫苗10项,mRNA疫苗7项)。在研究进展方面,大部分(86项)的临床试验仍处于I期或II期,只有少数几项进入III期。
小编有话说
目前,以新抗原为基础的肿瘤疫苗临床试验正在如火如荼地开展,在不同肿瘤类型中取得疗效突破的好消息也不断传来。个性化新抗原肿瘤疫苗已经在延长晚期实体瘤患者生存期方面展现了不错的实力。
随着肿瘤和免疫相互作用机制的深入理解,肿瘤新抗原疫苗将开启精准治疗的新时代。尽管个性化新抗原肿瘤疫苗的研发和应用还存在诸多的挑战,但是随着对新抗原预测研究的持续深入和验证数据库不断积累,以及树突细胞疫苗、mRNA疫苗等不同路径的尝试已经在临床上得到积极验证,新抗原肿瘤疫苗的研发脚步正在不断加快,预计未来几年将迎来飞速发展,给广大肿瘤患者带来福音。
参考文献
1.https://www.nature.com/articles/s41591-020-01206-4
2.https://www.onclive.com/view/adjuvant-neoantigen-peptide-vaccine-pgv-001-shows-promise-in-multiple-malignancies







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城