非小细胞肺癌抗癌成功案例,来看看他们的他们的共同特点-EGFR抑制剂序贯治疗
肺癌是公认的“第一大癌种”,是每年导致患者死亡最多的恶性肿瘤。非小细胞肺癌是肺癌当中占比最高的亚型。在化疗时代,非小细胞肺癌患者接受化疗的1年生存率仅有约29%,是靶向药物的发展,让非小细胞肺癌迎来了一次巨大的生存期提升。
目前,使用靶向治疗方案,部分非小细胞肺癌患者已经能够实现超过5年的生存或治愈。其中,EGFR抑制剂治疗EGFR突变的转移性肺腺癌患者的5年生存率可以达到14.6%。不过,想要真正地实现实现长期生存(>10年),仍然是非常大的挑战。
非小细胞肺癌抗癌成功案例
这一次,基因药物汇将与大家一起分享三份案例报道——这些案例有一个相同的特点,那就是,在多线、多类型的复杂治疗的努力之下,患者的生存期都超过了十年,是长期荷瘤生存者!
案例一[1]:71岁日本男性,生存11年
这位患者为71岁男性,于2007年8月确诊了Ⅳ期肺癌(T4N0M1a)。左下肺叶有一个3厘米直径的肿瘤病灶,左上叶有一个5毫米直径的结节,被认为是转移病灶。
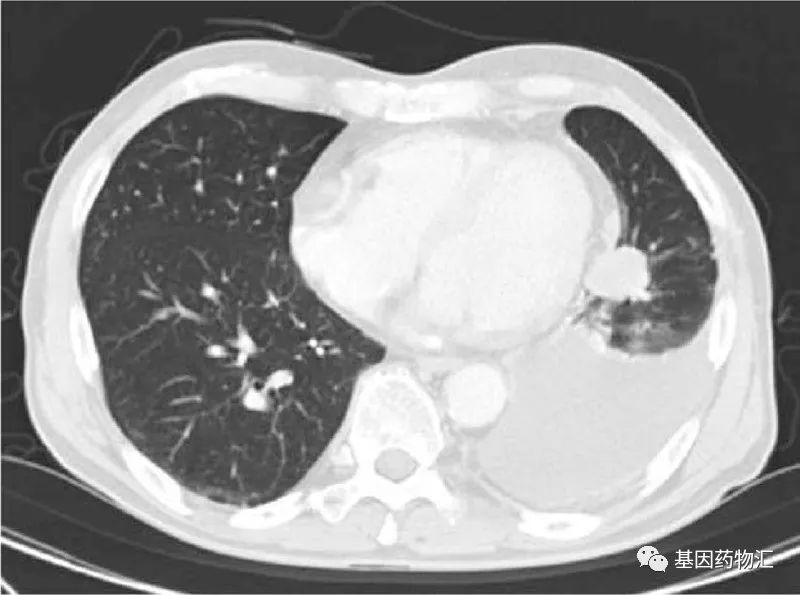
2007年8月确诊后,患者开始接受卡铂+多西他赛方案化疗;4个周期后,主要病灶直径缩小到1厘米;但在治疗8个月后,患者的疾病发生了进展。
2020年8月,患者接受了相同化疗方案的“再挑战”,接受了6个周期的卡铂+多西他赛方案治疗;此后,每次患者发生疾病进展时,都给予4~6个周期的再挑战化疗。
至2013年的6年时间里,患者共完成了38个治疗周期。直至此时,再挑战化疗已经无法再达到相同的控制胸腔积液、减轻症状效果;且由于大量的胸腔积液,患者的原发病灶大小难以评估,医生选择采用CEA这项指标来评估疗效。
至2013年10月,在反复化疗之后,患者的CEA从4.6 ng/ml增长至33.3 ng/ml。此时,患者的EGFR突变状态仍是未知,但医生做出了一个冒险的决定:盲试EGFR抑制剂。
由于EGFR突变在亚洲人当中的阳性率比较高,且EGFR抑制剂的疗效比较好、价格又相对比较容易接受,因此这种盲试EGFR抑制剂的做法在患者当中是存在的。
当然,如今各种基因检测技术的发展很快,水平完全超越了十年前,所以如果有机会的话,大家最好还是完善基因检测,根据检测结果精准指导用药。
患者接受了厄洛替尼治疗,非常幸运的是,CEA水平下降了。8周后,患者发生了比较严重的不良反应,3级痤疮样皮疹,根据不良事件处理规范,停止给药6周。待缓解后,患者再次开始厄洛替尼治疗,并保持相同的停药周期,密切关注皮疹情况。
期间医生曾经尝试为患者减少剂量,但会导致CEA水平升高,疾病控制不佳,且皮疹仍然持续,故而沿用周期性用药的方案。
这样的周期性用药持续了3年。在这三年里,患者的病情一直保持着规律性的控制。但在2017年1月,检查发现患者的CEA从3.1 ng/ml增长到了30.4 ng/ml,厄洛替尼可能已经无法发挥疗效了。
此时,患者接受了胸腔积液的癌细胞分析,检测到了EGFR外显子19缺失和外显子20 T790M突变——T790M是非常典型的第一代EGFR抑制剂耐药突变,因此,患者开始接受奥希替尼的治疗。
奥希替尼发挥了良好的疗效。至2018年8月,患者的CEA水平控制仍然良好。至末次随访时,患者自确诊肺癌之后,已经存活超过11年!
71岁的患者,荷瘤生存长达11年以上,这可谓是一个医生决策成功的典型案例!通过医生对用药方案及用药剂量的考究,再加上EGFR抑制剂可靠的疗效,患者终于创造了这样的长期生存“奇迹”。
而后四年中厄洛替尼与奥希替尼的序贯方案,也发挥出了非常出色的疗效,延长了患者的生命。
案例二[2]:48岁中国女性,生存接近12年
患者48岁,中国女性,于2009年7月25日入院,确诊为左肺腺癌伴左锁骨上淋巴结转移,分期为ⅢB期(cT1N3M0)。
患者首先接受了吉西他滨+顺铂2个周期治疗,但随后患者本人拒绝继续接受治疗,并要求改用EGFR抑制剂治疗。
此时患者并没有检测到EGFR敏感性突变,但经过医生与患者之间的沟通,结合前期研究当中,EGFR抑制剂的疗效与“女性、非吸烟者、腺癌”的临床特征呈现正相关的表现,医生决定为患者使用吉非替尼治疗。
患者从2010年1月15日开始接受吉非替尼治疗,过程中未发生明显的不良反应。截至2010年3月1日,患者的CT影像显示胸部左室上淋巴结和左肺病灶开始缩小。这一次尝试对于患者益处很大!
2015年7月6日,患者因头痛前往医院复查,脑部核磁共振显示了疑似转移性病灶。此时,患者肺部及淋巴结的病灶已经消失。随后患者接受了针对脑转移病灶的局部放疗,头痛症状有所改善。
但此时患者已经发生了脑转移,可能需要考虑更换方案。2015年9月,患者开始接受奥希替尼维持治疗。治疗过程中进行的基因检测,都提示患者的ALK、ROS1及EGFR突变为阴性。此后的复查提示,患者的肺部出现了转移性病灶,CA125水平逐渐上升,怀疑为奥希替尼耐药。
2020年9月至11月期间,患者接受培美曲塞+奥沙利铂治疗,联合腰椎病灶的热疗,症状缓解了,但肺部病灶仍有进展。12月,患者更换为特瑞普利单抗+安罗替尼方案治疗。
2021年4月复查显示患者非转移病灶增大。此时患者的ALK、ROS1及EGFR突变仍为阴性,但考虑到患者从2010年以来一直受益于EGFR抑制剂的治疗,且接受免疫治疗及抗血管生成抑制剂治疗均没有疗效,因此仍然选择了EGFR抑制剂靶向治疗。
患者接受了双倍剂量的埃克替尼治疗,肺部转移病灶一直有缩小。2021年6月19日,患者因昏迷入院,并最终在抗癌12年后,死于脑梗。
案例三[3]:60岁女性,生存超过10年
患者60岁,女性,有大约6年的吸烟史,于2005年1月确诊右下叶肺癌,分期为Ⅳ期(cT4N1pM1a)。
患者首先接受了6个周期的含铂双药化疗,于2005年11月复查进展。随后的活检显示患者存在EGFR外显子19缺失突变,接受了来那替尼(Neratinib,一款泛HER抑制剂,对于EGFR[HER1]与HER2都有一定的抑制效果)治疗,并在3个月后,因为严重的不良事件而停止。
随后,患者接受了BMS-690514的临床试验。这是一款多靶点抑制剂,对于HER1/2/4以及VEGFR1~3都有抑制效果。整体来说,这一方案的疗效不错。但由于不良反应,患者先后经历了减量、中断以及重新治疗,至治疗15个月后,患者接受了减瘤手术治疗。随后,患者又接受了5个月的BMS-690514治疗后停药。
1年后,患者疾病复发,吉非替尼治疗1个月无响应,随后更换为厄洛替尼治疗方案。这一方案为患者带来了3年的疾病稳定,至2013年10月,患者接受了AZD-9291的临床试验——也就是我们非常熟悉的奥希替尼。
奥希替尼同样为患者带来了长久的缓解。至2015年1月随访时,也就是患者确诊肺癌之后的第10年,她仍然保持着良好的缓解。
三个案例看完,相信大家已经发现了一些共同点.我们来简单总结一下:
1、尽管并非每位患者都检测到了EGFR敏感性突变,但这三位患者都在治疗的某个阶段接受了EGFR抑制剂的治疗。
其中71岁男性患者和48岁女性患者都来自亚洲地区,而EGFR突变在亚洲患者、尤其是女性以及无吸烟史患者当中的检出率都非常高。报告中也指出,EGFR抑制剂的疗效与“女性、非吸烟者、腺癌”的临床特征呈现正相关,因此医生选择了“盲试”EGFR抑制剂。
也许有的患者曾经听过这样的一句话,“EGFR抑制剂,是上帝赐给东方人的礼物。”EGFR突变在亚洲患者当中的检出率高,且与其它人种相比,EGFR抑制剂对于亚洲患者的疗效格外好,因此,患者们在治疗的过程中,一定要格外关注这一突变。
2、这三位患者,在治疗的某个阶段都曾经应用过联合方案,例如药物或放疗减瘤后手术,或接受头颅放疗之后接受全身性药物治疗等方案。
癌症的治疗非常依赖多学科协作、内外科联动,只有充分利用内外科不同治疗手段的优势,才能取得最理想的疗效。
3、部分患者,曾参与过临床试验(例如奥希替尼的临床试验),在药物未上市之前,勇敢尝试了新方案。
我们说靶向治疗的研发与批准很快,但这种速度仍然很难追上癌症发展的速度。因此,部分情况下,尝试临床试验、提前接受一些尚未上市的药物的治疗,对于癌症患者们来说,同样是一次值得把握的机会。
序贯治疗,EGFR的"通关秘籍"
与其它类型的靶向药物相比,EGFR抑制剂的序贯疗法已经有了比较完备的体系。从第一代EGFR抑制剂吉非替尼、埃克替尼和厄洛替尼,到结构优化的第二代的阿法替尼和达克替尼,再到第三代奥希替尼,以及正处于临床研究阶段的多款第四代新药,EGFR抑制剂的研发,可以说是靶向治疗中的一柄“标杆”。
充分发掘这几代药物的特点、周密谋划序贯治疗方案的情况下,EGFR突变的非小细胞肺癌患者,生存期可以达到5年甚至更长!
"1+3",中位总生存期58.0个月
2019年WCLC大会上的报告指出,采用“1+3”模式治疗,即在接受一代EGFR-TKI耐药后继续使用三代药物治疗的患者中,发生T790M突变的患者中位总生存期能够达到58.0个月!
"2+3",中位总生存期47.6个月
同一报告中同样指出,在采用“2+3”模式治疗的患者中,发生T790M耐药突变的患者中位总生存期可以达到41.3个月。
而在2020年公开的现实世界研究,第三阶段的GioTag研究中则指出,使用阿法替尼(Afatinib,Gilotrif)+奥希替尼的“2+3”序贯治疗方案,患者的中位总生存期为47.6个月,预估2年总生存率为85%;目前的数据成熟度仅有35%,还有很大的提升空间!
"3+X",获益患者更多
上述两种方案的生存期数据都非常可观,只要能够对药物响应、且坚持完成了全部治疗,那么就有将近一半的概率能够跨过5年生存这个坎。但现实世界的统计数据显示,“1+3”方案的获益人群比例大约25%,“2+3”方案更低,只有大约10%。效果虽好,但如果绝大部分患者都耐受不下来、完成不了治疗,那这样好的疗效也只是曲高和寡,鲜有人和。
而奥希替尼一线治疗方案的落地,则是让患者们看到了全新的希望。
根据Ⅲ期FLAURA试验的结果,奥希替尼一线治疗EGFR突变的非小细胞肺癌,中位无进展生存期为18.9个月,中位总生存期为38.6个月。研究者认为,使用“3+X”的序贯方案,患者的预估中位总生存期可以超过40个月。
研究者指出,“3+X”方案的缓解率将远远超过“1+3”与“2+3”。以奥希替尼为一线治疗方案,优势将最大限度地体现于获益患者数量上。
奥希替尼不敏感?罕见靶点也有"专用药"
事实上,从第一代到第三代EGFR抑制剂,疗效最好、患者最敏感的突变亚型其实是EGFR突变中19号外显子缺失和21号外显子L858R突变。这两种亚型在所有的EGFR突变中占比非常高,几乎接近80%。

但临床试验同样证实,有一部分EGFR突变亚型的患者,对于包括奥希替尼在内的EGFR抑制剂并不敏感,甚至是原发耐药,导致他们从一开始就无法考虑这些主要针对常见突变亚型患者的序贯治疗方案。
这其中,就包括了“臭名昭著”的EGFR难治亚型,20号外显子插入突变(ex20ins)。
EGFR ex20ins患者生存期究竟如何?许多大型现实世界统计研究都给出了回答。在一项筛选了62464例晚期非小细胞肺癌患者的统计研究中,ex20ins患者的中位无进展生存期仅有2.86个月,中位总生存期仅有7.45个月,与其它EGFR突变亚型的10.45个月和25.49个月相比,甚至不到三分之一。
奥希替尼治疗ex20ins患者的缓解率约为24%,与其它EGFR亚型天差地别。
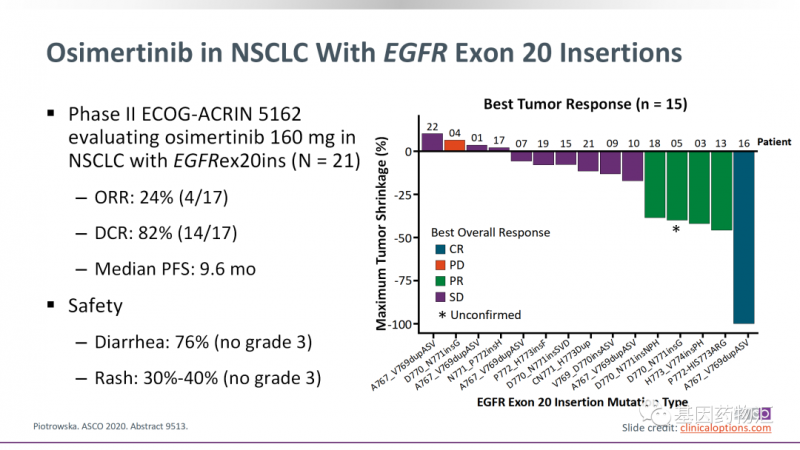
但随着研究重心的倾斜,目前临床上已经有了越来越多的EGFR ex20ins抑制剂临床试验,患者的治疗前景非常光明。
Mobocertinib(TAK-788)治疗的整体缓解率为35%,中位治疗时间13.9个月,中位无进展生存期7.3个月。
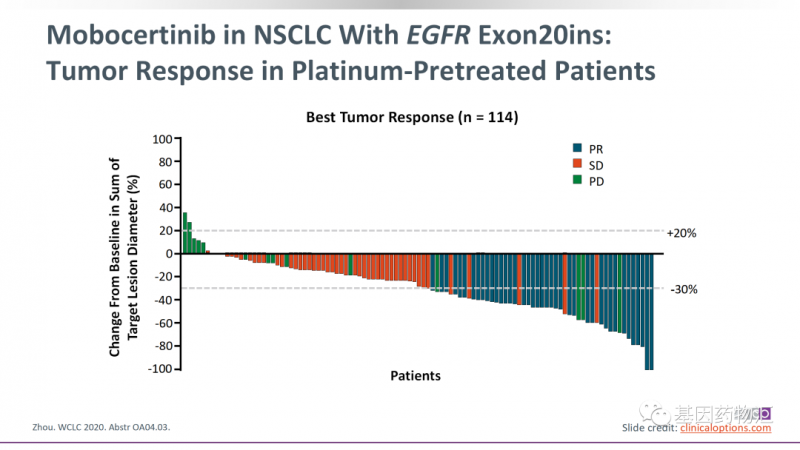
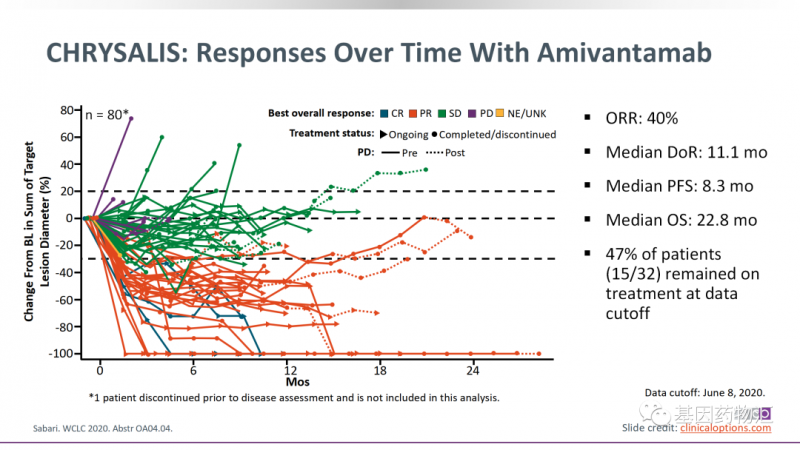
Amivantamab(JNJ-6372)治疗的整体缓解率为40%,中位治疗时间11.1个月,中位无进展生存期8.3个月,中位总生存期22.8个月。
Poziotinib治疗的整体缓解率为27.8%,中位缓解持续时间6.5个月。
目前,针对EGFR ex20ins患者的临床试验非常多,有需求的患者,以及希望参与临床试验、尝试新药治疗的患者,可以联系基因药物汇了解详情。
奥希替尼耐药?"后奥希替尼时代",个性化治疗成主流
除了对奥希替尼“原发耐药”,自然还有一部分患者,在用药一段时间之后会对奥希替尼“继发耐药”。
从临床治疗的角度来说,对奥希替尼耐药的患者,已经至少接受过2线方案治疗。对于这部分患者来说,后续方案的选择更需要将规范化与个性化结合起来。
想找到一种效果比较好的方案来应对包括奥希替尼在内的第三代EGFR抑制剂耐药,那么首先就需要搞清楚患者为何会对奥希替尼耐药。简单来说,患者对于奥希替尼耐药的原因可以分为两类:一类是依赖EGFR的机制,一类是不依赖EGFR的机制。
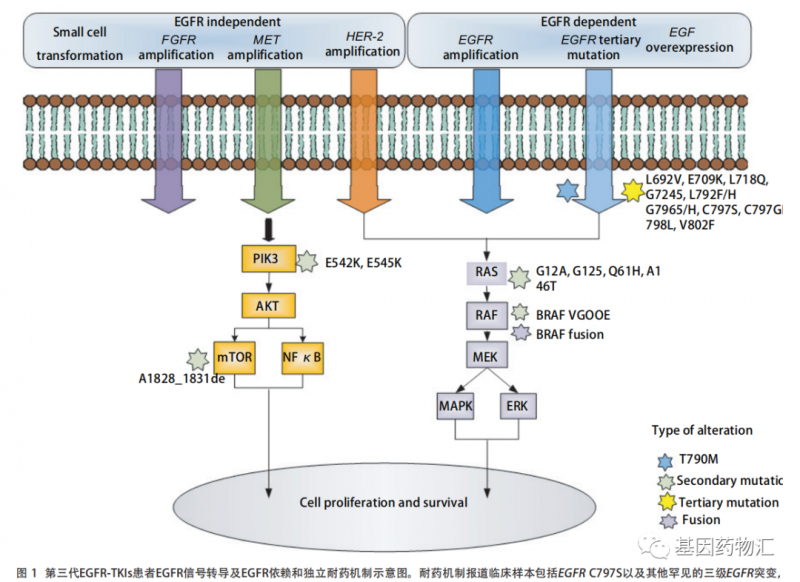
图片来源:《奥希替尼在非小细胞肺癌靶向治疗中的获得性耐药机制》DOI: 10.3779/j.issn.1009-3419.2020.103.0
除了病理类型转为小细胞肺癌以外,奥希替尼耐药患者常见的病理类型还包括EGFR Del19/T790M/C797S及L858R/T790M/C797S三突变(约占20%~40%左右)、MET(约占25%)、EGFR ex20ins、HER2/3、FGFR、RAS、mTOR等等。
EGFR C797S"最常见的耐药突变
大部分接受第三代EGFR抑制剂治疗的患者,耐药时间在1年左右,而如今距离奥希替尼的普及已经有3~5年的时间,患者对能够用于治疗第三代药物耐药的第四代EGFR抑制剂的需求,正在日益扩大。
EGFR Cys797Ser(C797S)突变是最常见的第三代EGFR抑制剂耐药突变,也就是T790M突变的患者,对于EGFR抑制剂再次耐药的时候最常见的突变类型。这种突变主要分为EGFR Del19/T790M/C797S和L858R/T790M/C797S三突变两类。
1、第四代EGFR抑制剂,"国研"走上世界前列
目前,首款走入临床试验阶段的第四代EGFR抑制剂是由我国药企研发的新药TQB3804。这款药物不以EGFR Del19等突变类型为主要靶标,而是专门针对第三代EGFR抑制剂耐药后常见的C797S突变,因此对于第三代药物耐药后患者的治疗效果更加出色。
目前,TQB3804在临床前试验中已经展现出了良好的效果,进一步的人体试验项目正在进行,我们会密切关注试验结果。
除此以外,由外国药企研发的BLU-945在临床前研究中也展现出了出色的潜力,目前正在进行进一步的临床试验。
2、顺式?反式?部分患者可从前代药物治疗中获益
因EGFR抑制剂耐药而导致的T790M/C797S突变还分为顺式突变和反式突变,对于耐药后治疗有着重要的影响。
我们都知道,人体DNA是双链结构,当T790M和C797S突变出现在同一条DNA链上时被称为T790M/C797S顺式突变,当这两个突变出现在不同的DNA链上时被称为T790M/C797S反式突变。临床上顺式突变比较多见,约占85%。
但从治疗的角度来说,这部分比较少见的反式突变患者可能是比较“幸运”的——这部分患者对于第一代+第三代EGFR抑制剂的联合方案比较敏感。
许多临床应用案例都证实了这种方案的效果,在ASCO大会上也曾经公开了一项小规模的试验结果。使用第一代EGFR抑制剂吉非替尼+第三代EGFR抑制剂奥希替尼联合治疗,患者的中位无进展生存期约为22.5个月,整体缓解率高达88.9%;病情持续进展的患者,耐药的原因均为旁路扩增等,均未检测出C797S、T790M突变。但这种方案的缺点在于,患者的治疗中经历的不良反应比较明显,耐受性稍差。
相信有不少患者已经从这种治疗模式中获益,我们非常希望研究者可以进一步优化治疗方案,明确适应症范围,并减少或降低不良反应,使更多患者从中获益。
MET:分多种亚型,部分亚型已有药物上市
从第一代到第三代EGFR抑制剂,MET都是一个让医生与患者非常头疼的耐药突变类型。且与MET相关的亚型非常多,包括MET扩增、c-MET过表达、MET外显子14跳跃突变等等,即使使用相同的药物,这些亚型的疗效也不一样,整体并不理想。
直到近两年MET抑制剂以及EGFR/MET“双抗”问世之后,这些患者终于迎来了新的希望。
1、MET抑制剂:多款新药问世,耐药、脑转移患者均可获益
近两年获批上市的MET抑制剂不少,包括率先经日本厚生劳动省批准的特普替尼、经美国FDA批准的卡马替尼、以及经中国MNPA批准的沃利替尼等等。这些已经上市的药物与临近上市的新药,在MET突变患者的治疗中均展现出了远超既往方案的效果。
其中瑞普替尼治疗的整体缓解率达到42.4%,卡马替尼治疗的整体缓解率达到了67.9%,两款药物的疾病控制率均超过了90%,且缓解持续时间分别达到了12.39个月和9.72~11.14个月。
而特普替尼在发生了脑转移的患者的治疗中也展现出了良好的潜力,患者的全身客观缓解率为52.4%,疾病控制率76.2%;中位缓解持续时间9.5个月,中位无进展生存期9.5个月。
使用沃利替尼治疗MET外显子14跳跃突变患者,整体缓解率为49.2%,疾病控制率达到了93.4%,中位缓解持续时间9.6个月。
亚组分析结果显示,初治患者整体缓解率54.2%,疾病控制率达到了95.8%,中位缓解持续6.8个月;在经治患者中,沃利替尼治疗的整体缓解率也达到了46.0%,疾病控制率同样高达91.9%。曾经接受过化疗、免疫治疗或靶向治疗等多线治疗的患者,中位无进展生存期达到了13.8个月。
2、EGFR/MET双抗:"双管齐下"、突破耐药困境
既然MET突变是EGFR耐药最重要的原因之一,那么使用双靶点抑制剂、即“双抗”药物,是否能够将治疗的效果再次提升一个台阶?
这样的治疗思路也受到了重视。在这项试验当中,研究者分析了使用EGFR/MET双抗Amivantamab-vmjw(Rybrevant,JNJ-6372)以及第三代EGFR抑制剂拉泽替尼(Lazertinib)联合方案,共同治疗奥希替尼及铂类化疗后疾病进展的非小细胞肺癌患者(不局限于MET异常)的疗效,已经取得了不错的前期数据!
数据公布时,中位随访时间为4.6个月,在80例可以评估的患者当中,整体控制率高达41%!患者的临床获益率,即包括11周以上缓解期的完全缓解、部分缓解及疾病稳定患者,共69%。
即使是已经接受过大量预处理的患者,即已经在前线使用过铂类化疗、奥希替尼以及其它多种治疗方案的患者,接受联合方案治疗的缓解率仍有21%,临床获益率51%。
JNJ-6372是一款近期备受关注的EGFR/MET双抗,已经经FDA批准了治疗EGFR ex20ins突变非小细胞肺癌的适应症。而这款药物独特的靶点组合,赋予它的潜力远超过了一个“难治突变”。
目前,JNJ-6372与拉泽替尼联合治疗奥希替尼耐药患者的中国中心临床试验,正在招募中国患者。这样的前沿方案试验机会非常难得,入组筛选也会更加严格。希望尝试申请这一试验的患者,可以联系基因药物汇,提交病例并申请进行入组评估。
3、奥希替尼+沃利替尼:奥希替尼耐药后MET异常的"解决方案"
早先我们提过ORCHARD试验很多次,认为这是一项真正将靶向治疗的“个性化”发挥到了极致的临床试验。
这项研究主要针对第三代EGFR抑制剂奥希替尼耐药的患者。研究中,所有受试的奥希替尼耐药患者都会再次接受基因检测,并根据检测结果施予治疗。
比方说,若患者的耐药表现为MET扩增,那么他们会接受奥希替尼+沃利替尼(Savolitinib,Volitinib,一款国产MET抑制剂)的方案治疗。根据目前已经公开的数据,这种方案的效果相当不错。
20例受试患者当中17例病灶可评估,这部分患者的整体缓解率为41%,疾病控制率为82%;此外3级或以上不良事件发生率为30%,3例患者(15%)因不良事件而停止联合方案治疗,但没有因不良事件而死亡的病例。
从癌细胞表面抗原突破:耐昔妥珠单抗"无视"耐药
耐昔妥珠单抗(Necitumumab)这个名字,相信不少患者都觉得有些耳熟。的确,尽管这款药物已经获批了肺鳞癌的适应症,但对患者疗效的改善并不明显,表现一直不温不火,与各类“突破性”的消息无缘。
但在2019年ASCO大会上,耐昔妥珠单抗一跃成为了“黑马”,再次被发掘出了从未有过的全新潜力。耐昔妥珠单抗+奥希替尼的联合用药组合,治疗各类EGFR抑制剂耐药的患者均获得了非常出色的缓解率。
其中,联合方案治疗第一二代EGFR抑制剂耐药的患者,整体缓解率29%;治疗第三代EGFR抑制剂耐药的患者,整体缓解率13%;其中,治疗T790M/C797S双突变的患者,整体缓解率竟达到了50%!
耐昔妥珠单抗这款药物很有特点。作为一款大分子药物,它的作用位点是癌细胞表面的EGFR受体,而非小分子药物所靶向的细胞内的酪氨酸激酶。在越来越多小分子药物以压倒性的优势取代大分子药物的如今,这款药物竟然又一次以“黑马”的身份亮相,让人不得不感叹,也许很多时候并不是药物的效果不好,而是没有找到这款药物最好的适应症,导致药物的“实力”发挥不太充分。
"后奥希替尼时代",新药将至、检测先行
除了上述几种相对比较常见的耐药突变类型以外,还有少部分患者因RET融合等突变而发生了耐药,尽管不像上述耐药类型的患者那样,已经有疗效比较明确的新药或新方案,但也有一些临床试验项目,正在针对这一耐药突变类型的治疗进行研究,例如奥希替尼联合塞尔帕替尼(Selpercatinib,即LOXO-292)方案等。
读完这篇总结,相信大家已经看到了“后奥希替尼时代”多样而个性化的治疗选择。但想要从中挑选出适合自己的一种,首先应当明确自己的耐药突变类型。
随着癌症精准治疗的发展,基因检测已经成为了每一名癌症患者确诊后必须进行的检测项目。不论是初治的患者,还是经过一系列治疗后发生了耐药的患者,都应当在基因检测的指导下选择最有可能获益的方案,才能真正有效地延长生存期。
奥希替尼耐药,患者的靶向治疗“目录”就翻到了结尾?当然不是这样。无数的研究者、医生都在不断地书写,扩充着这份能够为患者“续命”的“目录”,开启一个接续于“奥希替尼时代”之后的“后奥希替尼时代”。
我们衷心希望这些新药临床试验能够取得圆满的成功,将更多有价值的选择,送到癌症患者们的面前。
参考文献:
[1] A case report of metastatic lung adenocarcinoma with long-term survival for over 11 years
[2] Long-term survival in a patient with advanced non-smoking lung adenocarcinoma and no EGFR mutation after comprehensive therapy with EGFR-TKI-based therapy
[3] 10-year long-term survival of a metastatic EGFR-mutated nonsmall cell lung cancer patient







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城