T细胞疗法向消化系统肿瘤发起猛攻,T细胞免疫治疗胃癌、肝癌、胰腺癌等难治性肿瘤统统拿下
有人说消化系统恶性肿瘤是吃出来的,虽然有些言过其实,但不可忽视的是,不少消化系统恶性肿瘤的确与“吃”密切相关。根据《2017年中国肿瘤登记年报》显示,我国10大高发癌症中,5个跟“吃”有关。胃癌、结直肠癌、肝癌、食管癌、胰腺癌赫然在列,被视为吃出来的消化道肿瘤,占全部癌症发病率的43.3%,几乎占据了半壁江山。
从医学上讲,凡是与消化相关的器官所患的肿瘤都称作消化道肿瘤,包括肝脏、胰腺;狭义上说,消化道肿瘤是胃肠道肿瘤,包括胃癌和肠癌,这也是消化道肿瘤中最常见的恶性疾病。

人体的消化系统(图源摄图网)
需要注意的是,消化系统肿瘤具有高发病率、高病死率的特点。据国际癌症研究机构的癌症发病率和死亡率估计值显示:2018年全球有1810万癌症新发病例和960万癌症死亡病例。各类消化道肿瘤的发病率依次为结直肠癌(10.2%)、胃癌(57%)、肝癌(4.7%)、食管癌(3.2%)和胰腺癌(2.5%),死亡率依次为结直肠癌(9.2%)、胃癌(8.2%)、肝癌(8.2%)、食管癌(5.3%)和胰腺癌(4.5%)。消化道肿瘤已经严重损害到了人类的生命健康。
对于消化系统肿瘤,目前最有效的手段是手术,对于缺乏手术适应症及放疗、化疗效果不佳的患者,迫切需要寻找新颖且高效的治疗方式。
目前,免疫治疗已成为攻克癌症的不二之选,不仅是其疗效相比传统疗法(手术、化疗、放疗、靶向等)更为显著,还在于它的副作用相对较小,较为安全。
众所周知,作为白细胞的一种,T细胞在癌症的监控和杀伤中起着至关重要的作用,被称为人体内的“特种兵”,一旦遇到癌细胞,便会主动出击,歼灭敌人,因此称为“杀手T细胞”!
然而癌细胞为了躲避免疫系统的攻击,会伪装自己,让T细胞无法识别出它们,通过多种机制来抑制T细胞的抗肿瘤活性,从而逃避免疫系统的攻击。因此如何唤醒体内的T细胞、提高T细胞的活性、挖掘新型T细胞来对抗癌症成为国内外医学研究者们研发的方向。
目前,基于T细胞的免疫疗法有CAR-T疗法、TCR-T疗法及TILs疗法已问世,下面小编就带领大家看看T细胞疗法如何在消化道肿瘤中“大显神通”的!
无声的杀手——胃癌
据全国肿瘤登记中心最新数据估计,胃癌位居同期恶性肿瘤发病第2位。其整体预后较差,5年生存率仅10%~30%,晚期胃癌患者5年生存率低于10%,晚期胃癌一线治疗的研究结果显示,总生存期(OS)在不断延长,但中位生存期仍在12个月左右。
为了提高胃癌的生存率,全世界范围内已广泛开展免疫治疗。目前,已经发现了一些胃癌的肿瘤标志物,并对这些标志物进行了广泛的研究。
代表性胃癌CAR-T疗法研究进展
Claudin18.2靶点:CT041
Claudin18.2(CLDN18.2)是一种胃特异性膜蛋白,被认为是胃癌和其他癌症类型的潜在治疗靶点。基于此,中国研究人员开发了国际上首个针对 Claudin18.2的CAR-T细胞。
作为国际上首个针对Claudin18.2的CAR-T细胞,CT041早在2019年ASCO年会上就崭露头角,当时总客观缓解率为33.3%就已经惊艳世界,如今更加显著的疗效无疑是锦上添花!此次的临床数据展现出对消化系统肿瘤的良好治疗前景!
2022年5月9日,科济药业CAR-T细胞产品CT041治疗消化系统肿瘤的研究结果发表在国际顶级期刊《Nature Medicine》杂志上,这也算是首个发表于顶级学术期刊的迄今为止最大样本量的CAR-T细胞治疗实体瘤的临床研究!
截止到2021年4月8日,纳入的37例CLDN18.2表达阳性的晚期消化道肿瘤患者,其中包括28例胃癌/胃食管结合部癌、5例胰腺癌和4例其他类型的实体瘤,约84%的患者既往接受过至少2线治疗,中位转移器官数量为3个。
研究数据格外亮眼
1. 所有患者的客观缓解率达48.6%,疾病控制率达73%;所有胃癌患者总客观缓解率为57.1%。
2. 既往接受至少2线治疗失败的胃癌患者:客观缓解率为61.1%,疾病控制率为83.3%。
3. 而且总体耐受性良好!
截止到2022年3月3日,CT041成为全球首个且唯一进入到确证性Ⅱ期临床试验的用于治疗实体瘤的CAR-T细胞候选产品。这是CAR-T攻克实体瘤领域是里程碑般的存在,可喜可贺!
除此之外,还有多款靶向CLDN18.2的CAR-T细胞疗法。例如,由传奇生物研发的LB-1904,用于治疗胃癌或者胰腺癌,目前已经进入临床I期试验。此外,传奇生物还启动了一项靶向Claudin18.2 的CAR-T细胞制剂LCAR-C18S,用于治疗晚期胃腺癌患者,目前也正在进行临床试验招募中。
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性白血病、非霍奇金淋巴瘤、肝癌、胃癌、前列腺癌、甲状腺癌等癌种!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!
典型病例1
01、04号患者 53岁 男性
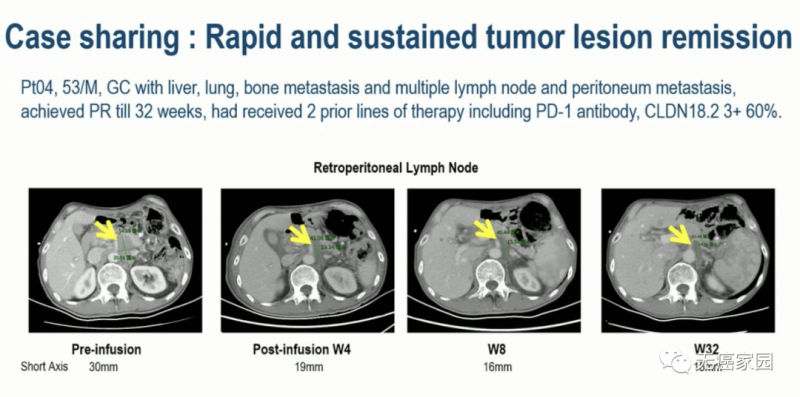
来源 CARsgen Therapeutics
晚期胃癌伴肝、肺、骨转移和多发淋巴结和腹膜转移,已接受包括 PD-1 抗体在内的2种全身治疗,CLDN18.2 60%(3+),接受CAR-T治疗后,肿瘤缩小近50%,持续缓解32周。
典型病例2
02、08号患者 57岁 女性
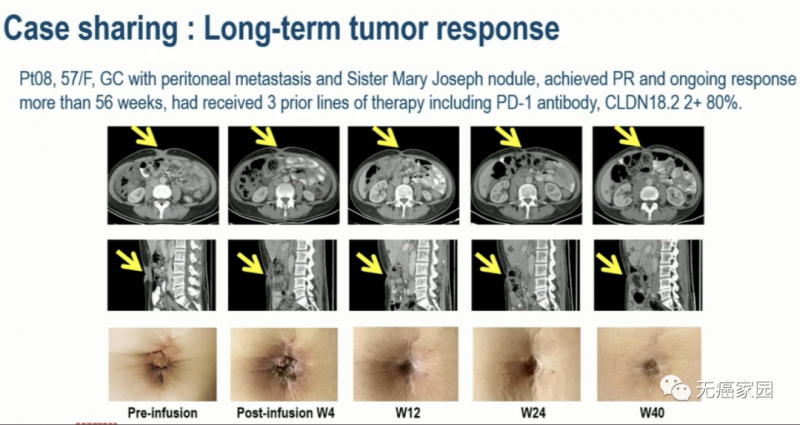
来源 CARsgen Therapeutics
GC有腹膜转移和玛丽约瑟夫结节(恶性肿瘤转移到脐部形成的结节样病变),之前接受过3线疗包括PD-1抗体,CLDN18.2 80%(2+),接受CAR-T治疗后达到部分缓解,并且持续反应超过56周。
EpCAM(上皮细胞黏附分子)靶点
EpCAM是一个过表达在多种肿瘤的跨膜糖蛋白,被认为是一种潜在的肿瘤干细胞标志物,有超过90%的胃癌过表达EpCAM,但是EpCAM也表达于胰腺等组织,所以针对EpCAM的单克隆抗体在临床中可引发胰腺炎,故针对EpCAM的CAR-T必须注意这样的风险。
MSLN(间皮素)靶点
靶向间皮素的CAR-T细胞在体外对胃癌细胞表现出强大的细胞毒性和细胞因子分泌能力,并显著抑制胃癌皮下移植瘤模型中肿瘤细胞的生长。
MUC1(黏蛋白1)靶点
MUC1是一种跨膜黏蛋白,广泛过表达在胃癌、肝癌、胰腺癌,目前已经广泛开展了抗MUC1的CAR-T治疗临床试验。
CEA(癌胚抗原)靶点
CEA最初发现于结肠癌和胎儿肠组织中,后被证实广泛存在于内胚叶起源的消化系统肿瘤,比如胃癌、肝癌、胰腺癌、结直肠癌。一项临床前研究显示,靶向CEA的CAR-T细胞可以诱导胃癌细胞发生凋亡。
HER2(人表皮生长因子受体2)靶点
Her2在大约10%的胃癌中过表达,针对Her2的单克隆抗体Herceptin也已经被批准用于Her2过表达的胃癌中。近期临床前研究显示,CAR-T-HER2细胞对HER2+的胃癌细胞具有特异性的杀伤效果。
MG7靶点
MG7是一种癌胚抗原的糖基化蛋白,是一种具有高特异性和敏感性的胃癌相关性抗原。目前有使用MG7靶点对胃癌进行治疗的临床试验。另外,也已经有关于MG7-CAR-T肝转移癌的临床研究正在进行。
难缠的"老大哥"——肝癌
据统计,我国原发性肝癌的发病和死亡例数占比分别占全球的54.6%和53.9%,更不幸的是,我国每年死于肝癌的约34.4万人,占世界肝癌死亡人数的55%,每一分多钟就会有一人死于肝癌。
相对于高死亡率,早期肝癌的发现比例却非常低,9成以上一经发现就已是晚期,此时已失去了手术治疗的机会,致使5年生存率仅为12%,中晚期肝癌患者的5年生存率更是低至3%。
T细胞疗法有望成为战胜肝癌杀手锏
01、CAR-T细胞疗法
目前,随着阿基仑赛注射液、瑞基奥仑赛注射液前后在中国获批上市,西达基奥仑赛被美国FDA获批上市,癌症治疗领域火速掀起一阵“CAR-T热”。当前应用CAR-T治疗肝癌的临床试验靶点主要是GPC3(磷脂酰肌醇蛋白多糖3)。
2021年ASCO年会上我国医学研究者们首次公布了靶向GPC3的CAR-T药物(Ori-CAR-001)治疗复发/难治性肝细胞癌的最新临床研究数据。该研究的初步数据显示,Ori-CAR-001在GPC3阳性复发/难治性患者中表现出良好安全性和有效性。
截至2021年3月10日,共纳入11名接受细胞输注的复发受试者。所有受试者均患有晚期肝细胞癌,并且经过化疗、TACE(肝动脉化疗栓塞术)和靶向治疗均无效。9例可评估受试者中,4例达到部分缓解 (PR),3例达到疾病稳定 (SD),2例出现疾病进展 (PD),客观缓解率为44%,疾病控制率达到78%。
典型病例
国际知名杂志《Journal of Hematology & Oncology》刊登了我国医学研究者们的一项成功改造CAR-T技术的临床研究,研究中提及的CAR-T产品选择的靶点是glypican-3(GPC3,主要是肝癌)。
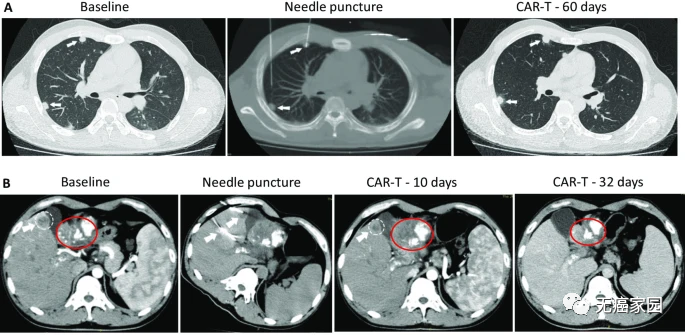
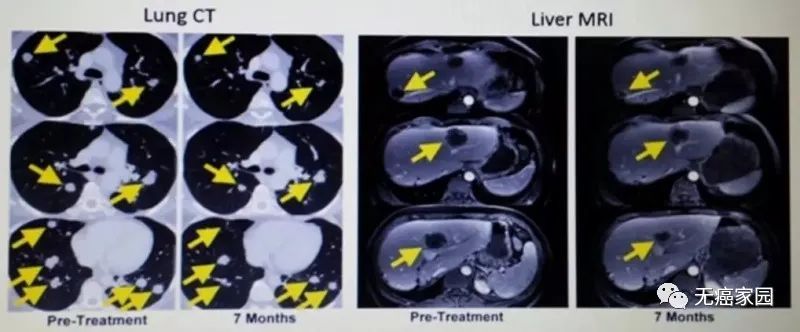
其中1例晚期肝癌患者接受了瘤内注射CAR-T治疗,治疗后肝脏病灶代谢基本消失。
CAR-T细胞注射60天后,虽然2个肺部结节的尺寸没有显著的改变,但在第10天时肝脏肿瘤病变(1.2×1.3cm)显著收缩,注射GPC3-7×19 CAR-T细胞第32天后则完全消失。
患者没有任何毒性作用,并且根据 CT 上的标准实体瘤反应评估标准 (RECIST) 1.1 版进行了分期评估,显示部分缓解 (PR)。
02、肿瘤浸润淋巴细胞(TIL)治疗
TILs疗法,简单点讲就是将手术切除的肿瘤组织中的淋巴细胞分离纯化,挑选出其中能特异性抗癌的淋巴细胞,扩增活化后回输。这类疗法拥有30多年的历史,最早用于恶性黑色素瘤,近年来在宫颈癌、肺癌等多种实体瘤中都给出了不俗的数据。
近日,《临床外科杂志》在线发表了国内学者关于TILs疗法技术在晚期肝癌中的临床试验,并观测到良好的安全性与有效性。TILs是一种过继性细胞疗法,分为两类:无筛选型TILs和筛查型TILs。随着抗PD-1治疗对肿瘤免疫逃避机制的抑制,以淋巴细胞为代表的肿瘤杀伤细胞可能对肿瘤发挥更佳的杀伤效应。TILs联合抗PD-1治疗理论上将会对肿瘤细胞发挥更有效地协同杀伤作用,这有望成为一种具有重大治疗前景的新型免疫联合治疗模式。
在目前进行的4例临床试验中,3例晚期肝细胞癌和1例肝内胆管癌患者的TILs体外扩增和回输均获得成功,TILs的最高扩增量达到3.5×1010个细胞。在4例患者中,仅1例患者出现I级不良反应,4例患者细胞注射前后均未发生III/IV级严重不良反应。目前这两例晚期肝癌患者随访时间已经超过1年。
这是目前国内外首次应用免疫检查点抑制剂联合过继性免疫疗法在晚期肝癌上观察到显著疗效。研究表明,TILs体外扩增后回输联合抗PD-1单抗治疗可能成为一种治疗肝癌的新方法。
若经济条件允许且想咨询TILs细胞疗法可将病理报告及治疗经历、出院小结等资料提交至无癌家园医学部,详细评估病情。
03、TCR-T细胞疗法
CAR-T 细胞和TCR-T细胞都属于经基因工程技术改造的T细胞。相较于CAR-T疗法,TCR-T疗法在实体瘤治疗领域具备独特优势。
TCR-T细胞疗法可识别细胞膜表面或细胞内来源的肿瘤特异性抗原,已从最开始的基础免疫研究走进临床应用,在实体瘤中显示出初步疗效,成为目前最有可能在实体瘤领域中取得突破的T细胞免疫疗法!
国内TCR-T细胞疗法获批临床,成为HBV相关肝细胞癌的潜在新疗法
目前,除了全球TCR-T处于如火如荼的研发及临床验证阶段,国内也在不断突破创新。
2021年12月22日,CDE(药品审评中心)官网能够查询到“SCG101自体T细胞注射液”的临床申请,此产品是一款针对特定乙型肝炎病毒(HBV)表位的TCR-T细胞疗法,是治疗HBV相关肝细胞癌(HCC)的潜在新疗法。

▲ 图片来源:CDE官网
晚期肝癌迎来新曙光!TCR-T疗法让癌症患者完全缓解
早在2020年国际肝病大会(ILC)上,一款基于T细胞的肝癌新型TCR-T疗法ADP-A2AFP引起了不小的轰动,也让肝癌的新疗法有了新的突破。
在纳入的患者中,有一名患者的癌细胞进程出现了完全缓解(CR)的表现,其余参与者的甲胎蛋白(AFP)也都出现了不同程度的下降,这意味着试验取得了进展,也说明该疗法针对晚期肝癌的治疗是有效果的。
无癌家园TCR-T疗法招募
那么到底有没有机会尝试TCR-T疗法呢?
小编这就带来了一个好消息,目前正有一项研发的TCR-T疗法在招募肝癌患者开展临床试验,想要参加的患者可以咨询无癌家园医学部了解详细入排标准。
癌中之王——胰腺癌
癌王之争一直都是个经久不衰的话题,要说起“癌王”,胰腺癌当之无愧。它是一种主要起源于胰腺导管上皮及腺泡细胞的恶性肿瘤,恶性程度极高,起病隐匿,早期诊断困难,进展迅速,生存时间短,是预后最差的恶性肿瘤之一。
胰腺癌患者往往在被确诊时,只有20%的人处于早期或中期,这意味着约有80%的患者没有机会救治,5年生存率仅有10%,预测2030年胰腺癌死亡率将仅次于肺癌。在很多人眼中看来,这无疑就是宣判了“死刑”,生命开始倒计时!
01、改造特殊CAR-T技术,让晚期胰腺癌病灶完全消失
7月29日,国际知名杂志《Journal of Hematology & Oncology》刊登了我国医学研究者们的一项成功改造CAR-T技术的临床研究,研究中提及的CAR-T产品选择的靶点是glypican-3(GPC3)和mesothelin(MSLN),为了使CAR-T细胞具有更强的进入肿瘤内部的能力,研究人员特地加装了白介素7(IL-7)和趋化因子CCL19。
其中疗效最绝的是1例晚期胰腺癌患者,接受的是静脉回输的CAR-T治疗,治疗后全身的病灶,基本都实现了代谢活性完全消失。
典型病例
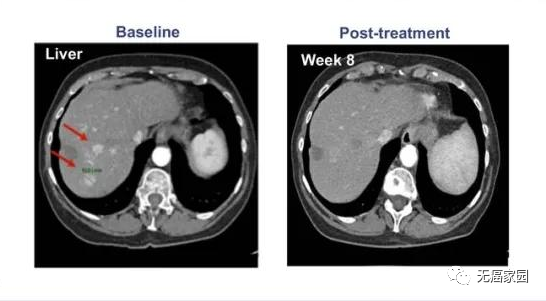
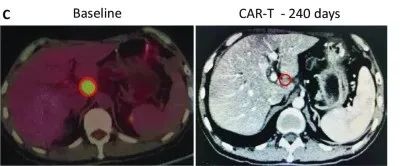
受试者GD-G/M-005 是一例具有 MSLN 表达的晚期胰腺癌患者。该受试者进展为局部淋巴结转移(24×33 mm)(图c)。抗 MSLN-7 × 19 CAR-T 细胞首先通过肝动脉输注,当晚伴有高烧,没有细胞因子释放综合征 (CRS) 或神经毒性。随后,他每1~2个月接受一次抗 MSLN-7×19 CAR-T 细胞的静脉输注。
直到增至CAR-T细胞输注的5倍,CT分期显示他在治疗240天后达到完全缓解,测定的淋巴结为8.3×9.6mm,并未见其他肿大的淋巴结(图C),患者此时病灶完全消失,保持正常状态。
02、"老树生新花",改良GoCAR-T技术数据惊艳
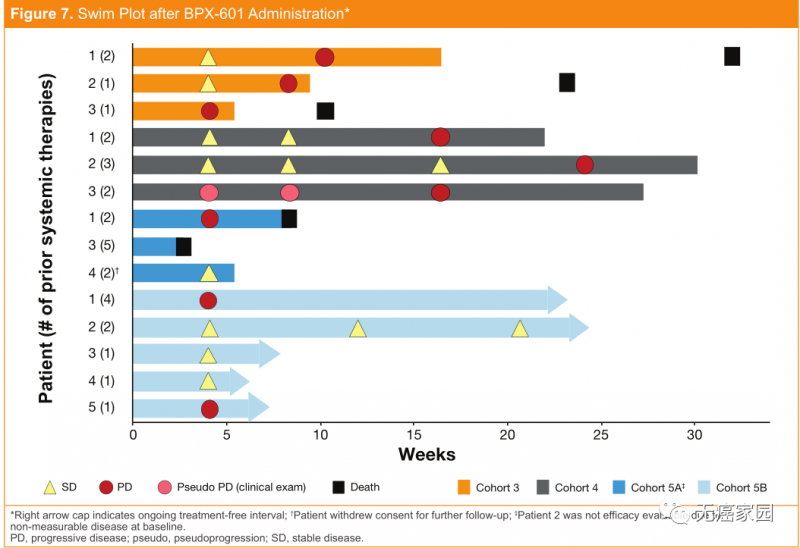
在2019年6月召开的ASCO年会上,Bellicum Pharmaceuticals公司公布了一项针对表达前列腺干细胞抗原(PSCA)的转移性胰腺癌患者的1/2期临床试验数据。该公司研制的一种新型的改良GoCAR-T技术——BPX-601,其安全性和活性数据都相当积极。迄今为止,BPX-601的耐受性良好,剂量限制性毒性未观察到。
与BPX-601相关的大多数不良事件为轻度至中度,给予或不给予支持性治疗均可得到缓解。
尽管临床试验设计相对保守,但在研究初期已观察到激发生物活性的证据!在13例可评估疗效的患者中,8例(62%)病情稳定,有3例患者的肿瘤缩小10%~24%。
BPX-601给药后各个患者的疗效情况
除了上述报道的国际CAR-T突破性临床研究外,当前应用CAR-T治疗胰腺癌的临床试验靶点包括CD133、EGFR、EpCAM、MUC1、CEA、HER2。若想了解更多CAR-T实体肿瘤的临床研究请持续关注无癌家园。
恶性程度较高的癌——结直肠癌
据2018年中国癌症统计报告显示:我国结直肠癌发病率、死亡率在全部恶性肿瘤中分别位居第3及第5位,其中新发病例37.6万,死亡病例19.1万。
然而不幸的是,多数患者在确诊时已属于中晚期。手术仅作为对患者的姑息治疗方法,或是仅用于消除对患者影响较大的症状,而以辅助治疗为主,一般治疗的预后都不理想。
自从肿瘤免疫治疗成为第四种癌症治疗方法,研究者们逐渐将目光投向近几年来的热门疗法——CAR-T疗法。
小编根据众多临床研究整理出结直肠癌中CAR-T细胞疗法的潜在靶点,主要包括抗4-1BB(ANTI-4-1BB)、癌胚抗原(CEA)、GUCY2C、TAG-72、EpCAM、上皮糖蛋白40(EGP40)、NKG2D、HER-2、重组人干扰素α/β受体1(IFNAR1)、prominin-1(CD133)、上皮糖蛋白2(EGP-2)。
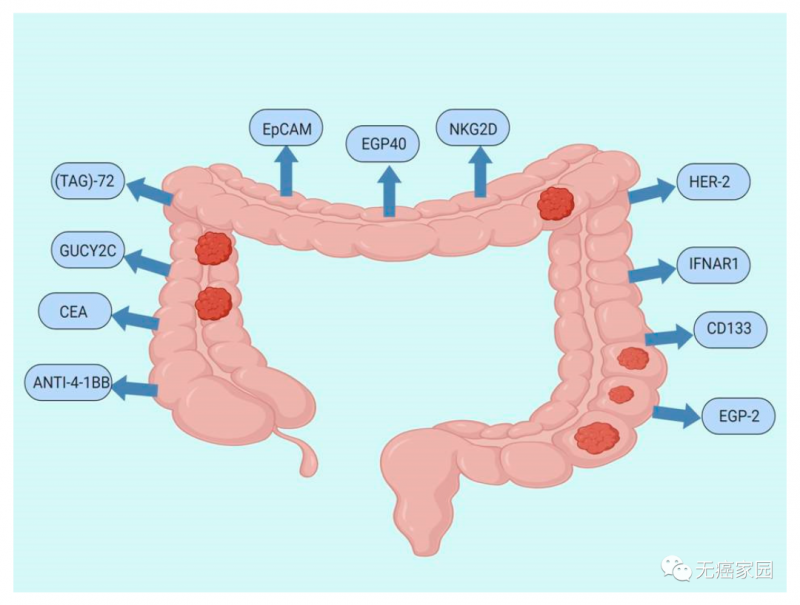
其中结直肠癌的有效靶点GUCY2C是近期研究热门,中国有一项针对7名患者的小型 CAR-T 研究,以结肠癌标志物GUCY2C为靶点。该研究发现,2~3 例患者出现部分缓解和疾病稳定。
被称为"生存噩梦"的癌症——胆管癌
胆管癌是起源于胆管黏膜上皮的最致命的恶性肿瘤之一,约占所有消化系统肿瘤的3%,发病峰值为70岁,男性略多于女性。中国胆管癌患者数较多,因而胆管癌研究在我国具有特殊意义。手术切除是所有胆管癌的最佳治疗手段,但由于早期诊断困难,仅10%的患者能够得到手术治疗。胆管癌患者术后5年生存率约5%,未切除胆管癌患者生存期<1年。
胆管癌的临床化疗效果并不理想,近期开展的进展期胆管癌CAR-T靶向治疗临床研究值得期待。目前有临床试验研究显示,一名被诊断为进展性手术不可切除的转移性胆管癌并拒绝放化疗的52岁女性患者,接受了CAR-T鸡尾酒免疫疗法,CAR-T细胞的靶点分别为EGFR和CD133.CAR-T-EGFR治疗后,患者有8.5个月的部分缓解,CAR-T-CD133治疗后,患者持续4.5个月部分缓解。
01、CAR-T疗法
在2018年3月,解放军总医院韩卫东教授的团队在国际知名《clinical cancer research》杂志上报道了利用EGFR CAR-T技术治疗胆道系统肿瘤的初步结果。
此次纳入的患者均为EGFR强阳性(>50%的癌细胞表达EGFR)的不可切除的胆道系统恶性肿瘤患者,共纳入19例患者,包括胆管癌14例,胆囊癌5例。
研究结果显示,17例患者可评估,其中1例胆管癌患者的肿瘤完全消失,截止到目前疗效已经保持了22个月,尚未发现疾病复发。10例患者疾病稳定,疗效保持2.5~15.5个月,中位无进展生存期为4个月。
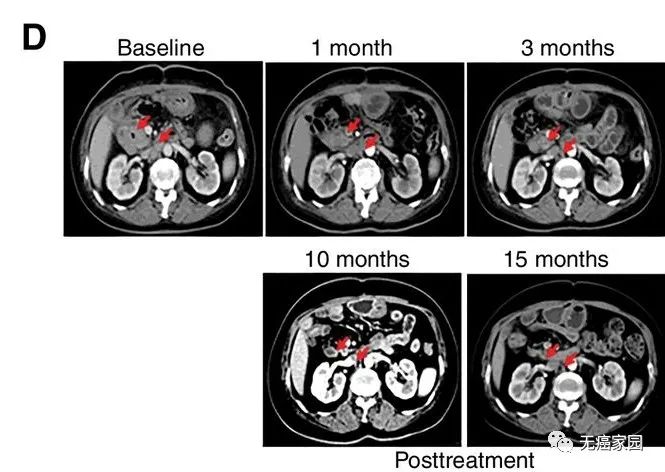
CART-RGFR细胞治疗之前和1、3、10和15个月患者1的CT扫描图像。红色箭头表示原发肿瘤和腹膜后淋巴结转移。
在研究中有10例患者在化疗预处理中出现3~4级的副作用,经积极处理均可恢复正常。
这是中国人自主研发的针对实体瘤的CAR-T第一次报道不错的临床疗效。极度恶性的胆管癌患者,首次出现了完全缓解,可喜可贺!
02、TILs疗法
2009年的秋天,对于41岁的Melinda Bachini来说终身难忘。就在儿子14岁生日的当天,她被诊断出患有罕见的胆管癌,被宣判生命只剩几个月,她的内心痛苦挣扎又不甘心。所幸命运对她不薄,现在已成为晚期胆管癌存活13年的幸存者!
从生存期仅剩几个月到成为超级幸存者,让Melinda重获新生的新型免疫疗法就是肿瘤浸润淋巴细胞(TIL)疗法。

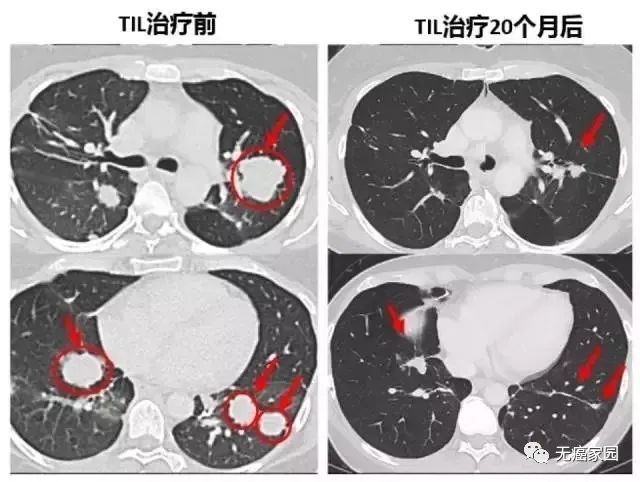
对Melinda发挥巨大作用的是第二次输入的1270亿个免疫细胞,起初她的肿瘤体积缩小60%,待试验结束后,又接受了免疫检查点抑制剂pembrolizumab的治疗,成功地缩小了肿瘤,目前身体任何部位已确保处于无癌状态。
下面的对照图可以非常明显看到,第二次治疗前肺部布满的肿瘤,包括一些个头非常大的,第二次TIL治疗20个月后复查,这些肿瘤都非常显著的缩小了,专家认为这很可能是瘢痕。
小编有话说
消化系统肿瘤占人体肿瘤的比例很大,尤其在我国占所有肿瘤的一半左右,因此亟待找到有效针对消化系统肿瘤的治疗手段。针对GPC3、CT041、CEA、CD133等靶点的CAR-T细胞为肝癌、胃癌、胰腺癌等消化系统肿瘤提供了潜在的治疗手段。另外再加上TCR-T疗法、TILs疗法、CTL疗法的加持,各大T细胞疗法纷纷向最难治的三大癌王发起猛攻!
总之,无癌家园小编相信,随着T细胞疗法的不断衍化,在不久的将来肯定会有更安全更高效的细胞免疫疗法成功用于治疗消化系统肿瘤,尤其是最难治的三大癌症,从而大大延长患者的生存期!







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城