靶向HER2的抗体偶联(ADC)药物Enhertu(DS-8201)已经在30个国家上市,DS8201中国临床试验招募也正在进行中
2022年7月19日,欧盟委员会正式批准了阿斯利康(AstraZeneca)和第三一共(Daiichi Sankyo)的抗体-药物偶联物(ADC)Enhertu(fam-trastuzumab deruxtecan-nxki,DS-8201)单药治疗方案,用于至少接受过一种抗HER2方案治疗的,不可切除或转移性HER2阳性乳腺癌成年患者。
根据阿斯利康官方网站的报道,目前Enhertu已经在超过30个国家获得了批准或临床试验许可。目前,Enhertu已经被验证或有明确疗效的适应症,囊括了HER2高表达以及部分低表达的乳腺癌、胃癌、肺癌以及结直肠癌。
“耐药患者也能获益”和“对HER2低表达的疾病也有疗效”这两点,直接让Enhertu成为了一款划时代的HER2抑制剂。
当然,我们最关注的一点还是,这款药物已经于3月在中国提交了申请,上市进入了倒计时!
1、HER2低表达患者也能获益
2022年6月21日,NCCN乳腺癌指南更新,支持在HER2低表达的转移性乳腺癌患者的治疗中使用Enhertu。
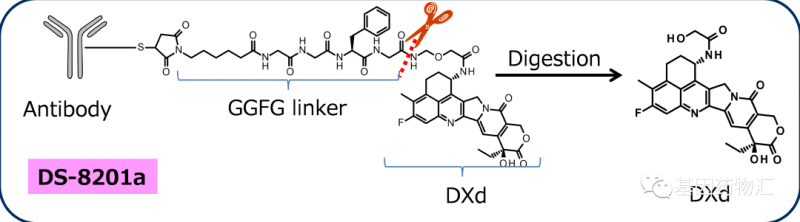
Enhertu结构图
Ⅲ期DESTINY-Breast04试验评估了Enhertu(trastuzumab deruxtecan,T-DXd,DS-8201)治疗HER2低表达乳腺癌患者的疗效,共纳入了557例乳腺癌患者。这些患者为HER2低表达患者,免疫组化评分为1+或2+,且不存在HER2基因扩增。
这些患者此前接受过至少1线、但不超过2线的化疗;其中激素受体阳性的患者,至少接受过1线内分泌治疗,且属于内分泌难治性疾病。
当前公布的结果分为两个部分:不论患者激素受体情况如何的一组数据,以及患者激素受体阳性的患者。
激素受体阳性+阴性
在所有激素受体情况的患者当中,接受Enhertu治疗的患者,中位无进展生存期为9.9个月,中位总生存期为33.4个月;接受化疗的患者,中位无进展生存期为5.1个月,中位总生存期16.8个月。
激素受体阳性
在激素受体阳性(HR阳性)的患者当中,Enhertu治疗的患者,中位无进展生存期10.1个月,中位总生存期23.9个月;接受化疗的患者,中位无进展生存期5.4个月,中位总生存期17.5个月。
这两组数据已经基本涵盖了所有HER2低表达的患者,不论激素受体是否阳性。这有两个重要的意义:一者,一部分三阴性乳腺癌(HER2表达比较低)的患者,可能能够摆脱“三阴性”带来的“魔咒”;二者,一部分激素受体阳性的患者,在对激素治疗耐药之后,很可能也能有靶向治疗选择。
自此,HER2靶点的ADC已经完全超越了HER2抑制剂曲妥珠单抗的成就,将HER2低表达的患者同样纳入适应症之内。再加上另一项试验当中,Enhertu完全超越了同为ADC药物的T-DM1,让我们对这类药物的潜力更加期待了——显然当前的成就并非终点,未来必定会有更令人惊艳的成果问世!
2、头对头试验,完全超越曲妥珠单抗
根据DESTINY-Breast03试验的结果,与T-DM1相比,Enhertu将患者发生疾病进展或死亡的风险降低了足足72%。
两者在缓解率上的差距非常明显,Enhertu治疗的患者整体缓解率为79.7%,T-DM1为34.2%。同为ADC药物,两者的缓解率竟然差了一倍有余!
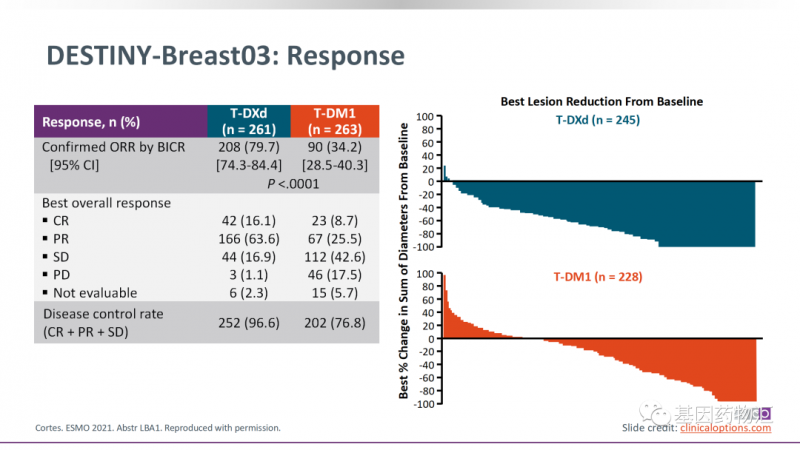
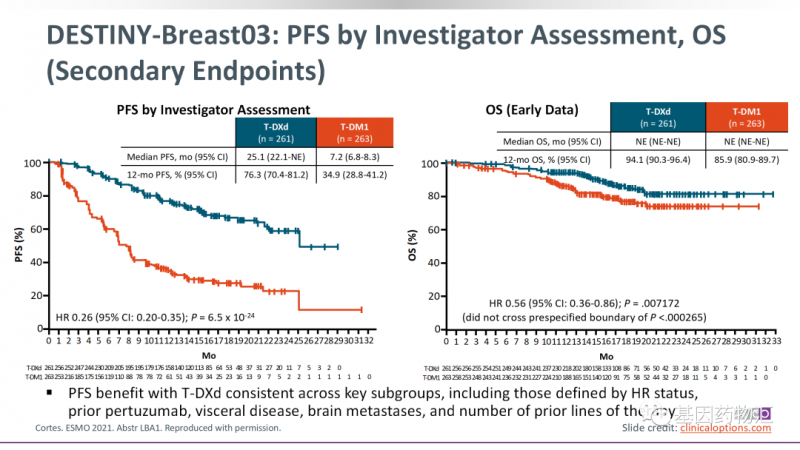
无进展生存期方面的差异更明显。接受Enhertu治疗的患者,中位无进展生存期为25.1个月,12个月无进展生存率为76.3%;而接受T-DM1治疗的患者,中位无进展生存期为7.2个月,12个月无进展生存率为34.9%。
除此以外,接受Enhertu治疗的患者,1年生存率为94.1%,T-DM1为85.9%。
3、非小细胞肺癌:缓解率55%,无进展生存8.2个月
Enhertu(Fam-trastuzumab deruxtecan-nxki,DS-8201)已经获批了乳腺癌和胃癌的适应症,除此以外,非小细胞肺癌以及肠癌的适应症也正在进行临床试验。其中非小细胞肺癌的中国中心临床试验项目正在招募患者,初治及经治患者均有机会参加,大家可以咨询基因药物汇了解试验详情或进行申请。
根据最近更新的DESTINY-Lung01试验结果,中位随访13.1个月时,接受Enhertu治疗的患者整体缓解率为55%,中位缓解持续时间为9.3个月,中位无进展生存期为8.2个月,中位总生存期17.8个月。
DS-8201治疗案例
一位52岁的女性患者,无吸烟史,诊断为Ⅲb期肺腺癌(cT1bN3M0)。患者检测了EGFR突变、ALK重排、ROS1重排、BRAF V600E突变以及MET外显子14跳跃突变,均为阴性,且PD-L1表达低于1%。
患者接受了同步放化疗,尝试了四种全身性治疗方案,其中还包括免疫检查点抑制剂方案(阿特珠单抗+贝伐珠单抗+卡铂+紫杉醇;雷莫芦单抗+多西他赛;培美曲塞;白蛋白紫杉醇),但最后的结果都是复发。
患者的疾病快速进展,直至呼吸出现困难、严重癌痛、恶病质,需要长期服用阿片类药物止痛。此时患者的体能情况已经非常的差,ECOG评分为3分。
孤注一掷下,患者再次接受了二代测序,这一次,检测到了HER2外显子20插入突变(M774-775ins)以及HER2扩增,患者终于有可用来指导靶向治疗的驱动基因突变了!
当时,Enhertu还未在日本获批(患者是日本人),但考虑到患者危重的情况,以及Enhertu在这类疾病治疗当中的潜力,药企给了她一个自费用药的机会。
不负众望的,接受治疗11天,患者的CT影像当中原发肿瘤开始缩小,肺转移病灶缩小、胸腔积液有了明显的改善;治疗13天,患者不再需要吸氧,体能获得明显改善,ECOG评分从3分变为1分;治疗23天后,患者甚至不需要继续住院了!
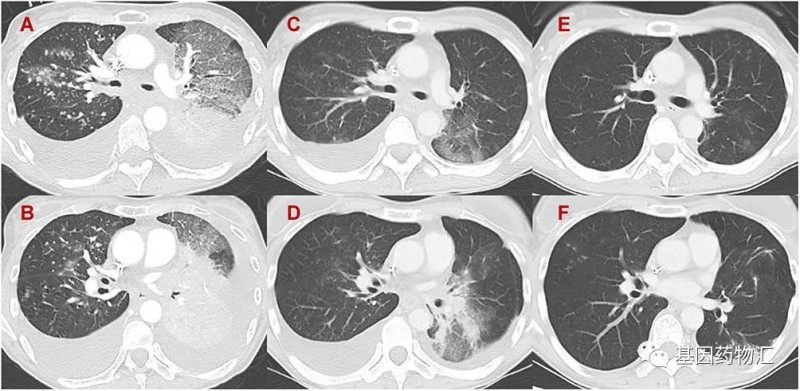
又是一次复查二代测序“救命”的案例。由此可见,如今的癌症治疗、尤其是非小细胞肺癌的治疗,有没有驱动基因突变是一个非常重要的“坎”,只要能找到突变,患者获得良好治疗的概率将有质的提升。
DS8201中国临床试验
目前Enhertu的部分中国中心临床试验项目正在推动,如果大家希望了解更多信息,或尝试这类项目,可以咨询基因药物汇了解详情。
●组织学证实非鳞状局部晚期、或转移性NSCLC
●受试者必须未接受过局部晚期或转移性疾病的姑息性全身治疗
●经证实的合格HER2外显子19或20突变
●必须获取肿瘤组织样本,送至中心实验室进行检测
●至少有一个根据RECIST 1.1标准判断的可测量的病灶







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城