2023年胃癌新药,3款新药为中国胃癌患者带来新曙光,100%患者肿瘤缩小或稳定
100%患者肿瘤不同程度缩小或控制稳定!2023年,一个全新的胃癌靶点闪耀全球,同时3款新药给晚期患者带来新的曙光!
在中国,胃癌是最令人望而生畏的癌症之一,全球将近一半的新发胃癌患者和死亡病例都在中国!更可怕的是,在中国大部分患者确诊时已处于中晚期,治疗的方式非常有限,患者的生存面临着严峻的考验。
近年来,针对HER2,PD-L1,MET,FGFR2等靶点的药物纷纷问世,为胃癌开启了一个全新的治疗模式,创造了新的可能性。近期,又一全新的靶点Claudin-18.2闪耀光芒,3款药物公布的数据显示疾病控制率高达100%,显示出强大的抗癌活性,为全球的胃癌患者带来新的曙光!
一、疾病控制率高达100%!全球首款Claudin18.2人源化单抗数据卓越
AB011是一款重组人源化抗Claudin18.2单克隆抗体注射液,这是我国自主研发的国际上首个针对该靶点的人源化单抗。已获得了国家药品监督管理局(NMPA)的新药临床试验申请(IND)批准,用于治疗Claudin18.2阳性实体瘤。
在刚刚结束2023年胃肠道癌症研讨会上,这款药物公布了最新的代号为AB011-ST-01的Ⅰ期临床数据,非常鼓舞人心。
这项研究入组的为CLDN18.2阳性的标准治疗失败、没有可用的标准治疗方案或无法获得标准治疗的晚期肿瘤患者,来评估AB011作为单一疗法以及与CAPOX联合用药的安全性和初步疗效。
结果显示:
23名接受AB011联合化疗后可评估的患者中,总客观缓解率(ORR)为52.2%;疾病控制率(DCR)高达100%。
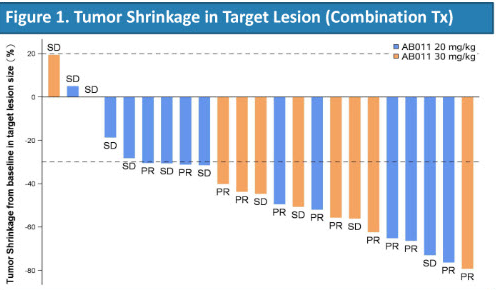
此外,在接受AB011单药治疗的35名晚期实体瘤患者中,2.9%的患者达到完全缓解(CR),22.9%的患者病情稳定。
上海东方医院肿瘤科主任李进教授说:“AB011单药治疗和AB011联合化疗在实体瘤中表现出可控和可耐受的安全性!”
我们期待这款药物能取得更多卓越的临床数据,早日上市造福胃癌患者。
二、100%患者肿瘤缩小或稳定,国研新药奥塞米单抗有望上市
中国研究人员成功开发全球第二款先进的CLDN18.2靶向抗体--osemitamab(奥塞米单抗,TST001),并已经在临床试验中展现出了卓越的疗效。
Osemitamab是一种高亲和力人源化抗Claudin18.2单克隆抗体,这款药物利用先进的生物工程技术使岩藻糖含量在生产过程中大大降低,进一步增强了NK细胞介导的抗体依赖性细胞毒性(ADCC)活性,可通过抗体依赖性细胞毒性(ADCC)和补体依赖性细胞毒性(CDC)的双重机制杀死表达Claudin18.2的肿瘤细胞。
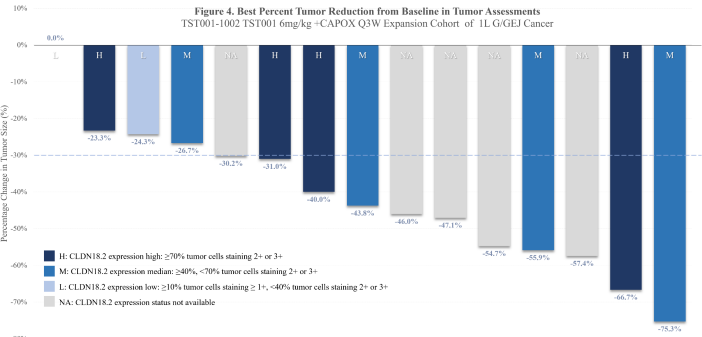
在2022年ESMO大会上提交的初步数据显示,Osemitamab联合卡培他滨和奥沙利铂一线治疗局部晚期或转移性胃/GEJ癌患者具有巨大潜力!
结果显示:在中位随访65天时,15名患者可评估,部分缓解(PR)率为73.3%(n=11),疾病控制率高达100%(n=15)!这意味着所有的晚期胃腺癌患者接受治疗全新方案治疗后病灶出现不同程度的缩小或控制稳定!
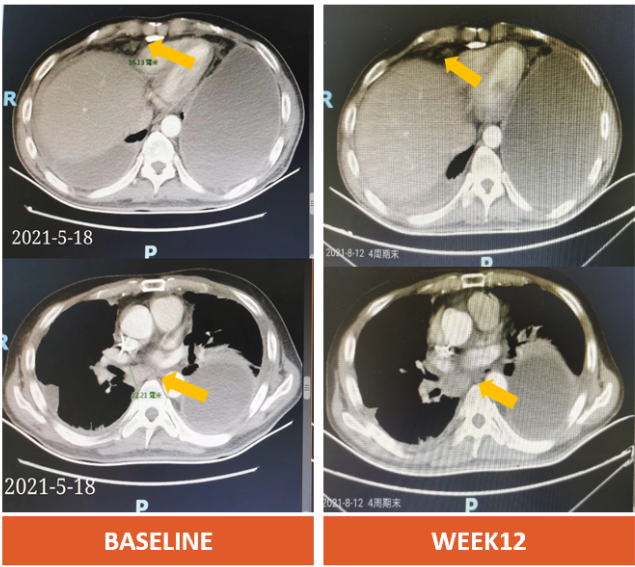
比如这位幸运的患者,42岁的M先生,晚期胃腺癌伴有腹膜转移,既往接受过化疗,靶向,免疫等多种治疗方案后疾病进展,接受Osemitamab治疗后仅6周,肿瘤显著缩小30%以上,评效达到部分缓解(PR),并且食欲增加,12周体重增加3kg。
目前这款药物仍在胰腺癌,胃癌,以及其他实体肿瘤类型中进行临床实验,根据官网显示,这款药物有望在2023年上市,我们也期待这款药物顺利上市造福患者。
疾病控制率高达100%!国研单抗ASKB589初战告捷
ASKB589注射液是我们国家自主研发的第3款人源化IgG1单克隆抗体,可与CLDN18.2高亲和力结合并具有增强的ADCC活性。
2023年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCOGI)上公布了这款国研药物的最新数据。
截至2023年1月04日,ASKB589I/II期临床研究(NCT04632108)共入组85例Claudin18.2阳性的实体瘤患者(单药治疗研究阶段40例,联合化疗给药阶段45例)。
结果显示:单药治疗中,观察到了明确的单药药效(有2例确认PR,DCR达47.6%)。
值得一提的是,24例接受≥6mg/kgASKB589联合CAPOX化疗方案一线治疗的CLDN18.2阳性胃癌或胃食管结合部腺癌患者中,客观缓解率达到了75%(18例),疾病控制率高达100%。
消化道肿瘤患者一定要检测的新兴靶点--Claudin18.2
相信这两款药物一定让胃癌患者感到鼓舞人心,需要病友们一定要知道的是,Claudin18.2是一个泛肿瘤的靶点,在多种上皮肿瘤当中都有表达,尤其在消化系统肿瘤中(如胃癌、胃食管结合部癌、食管癌和胰腺癌)异常过表达,比如,在胃癌或胃食管结合部癌中,在高达70%-80%的胃癌或胃食管结合部癌患者,以及60%的胰腺癌患者可检测到Claudin18.2的高度表达,成为近两年最具潜力的热门靶点。因此确诊胃癌、食管癌、胰腺癌等消化道肿瘤后,除了检测HER2,PD-L1,MET等靶点,一定要检测下Claudin18.2。
除了上面介绍的AB011、奥塞米单抗以及ASKB589,国内外还有多款针对Claudin18.2的新疗法已问世。
中国研究人员开发了国际上首个针对Claudin18.2的CAR-T细胞疗法--CT041
CT041,是全球唯一一款在中国和美国获得临床试验许可(IND)的CLDN18.2CAR-T细胞治疗。CT041已经在2020年被FDA授予治疗胃癌/胃食管交界处(GC/GEJ)癌的“孤儿药”称号,并在2021年被EMA授予治疗胃癌的“孤儿药”称号。
2022年ASCO大会上中国和美国的研究团队向全球展现了这项疗法治疗胃癌的卓越研究成果,也代表着中国的团队率先攻破了CAR-T疗法在实体瘤中的瓶颈!
临床研究数据显示:在胃/胃食管交界癌亚组中,据报道客观缓解率(ORR)高达60%,1名患者达到完全缓解(CR)。此外,80%(5名中的4名)的患者病情稳定,肿瘤不同程度缩小。
值得国内病友们振奋的是,目前这款CAR-T临床试验终于在中国招募患者啦,已有大量胃癌患者通过全球肿瘤医生网医学部成功入组!如想检测相关靶点或了解详情的病友可以致电全球肿瘤医生网医学部进行评估。
招募信息
| 疾病 | 治疗 | 阶段 |
| 晚期实体肿瘤(晚期胃癌,食管胃交界癌) | 药物:CAR-CLDN18.2 T细胞 | 阶段Ib/II |
唑贝妥昔单抗(Zolbetuximab代号IMAB362)进军一线
Zolbetuximab(代号IMAB362)是一类专门针对胃癌特异性靶点--CLDN18.2的IgG1单克隆抗体,这款药物能在肿瘤细胞表面特异性结合CLDN18.2,从而引起抗体依赖性细胞毒性(ADCC)、补体依赖性细胞毒性(CDC)、细胞凋亡和抑制细胞增殖。
2023年4月,国际重磅医学期刊《柳叶刀》上发表了代号为SPOTLIGHT试验(NCT03504397)的卓越结果,值得一提的是,这是首个靶向CLDN18.2的疗法在任何肿瘤类型中获益3期临床结果!
这项大型研究招募了来自20个国家/地区的565名先前未经治疗的CLDN18.2阳性、HER2阴性的局部晚期不可切除或转移性胃癌或胃食管交界腺癌患者,随机分配接受zolbetuximab(n=283)或安慰剂(n=282)加mFOLFOX6(改良亚叶酸、氟尿嘧啶和奥沙利铂)。
结果显示:
中位无进展生存期(PFS):10.61个月VS8.67个月;
中位总生存期(OS):18.23个月VS15.54个月;
值得一提的是,根据2023年美国临床肿瘤学会的报告,研究人员得出结论:zolbetuximab加mFOLFOX6是针对局部晚期不可切除或转移性GC或GEJ腺癌患者的3期试验中报告的最长中位OS之一,这意味着CLDN18.2阳性、HER2阴性疾病患者有望迎来新标准治疗方案。
ADC新星CMG901创下100%疾病控制率
CMG901是一种全新的ADC(抗体偶联药物),FDA于2022年4月授予CMG901快速通道资格,作为一种单一疗法,用于治疗复发和/或经批准的疗法难治的不可切除或转移性胃癌和胃食管交界腺癌患者。
目前正在中国进行的1a期试验(NCT04805307)的中期结果显示:共有13名晚期胃癌和胃食管交界腺癌患者和14名胰腺癌患者入组。8例接受CMG901治疗的患者客观缓解率(ORR)和疾病控制率(DCR)分别高达75%和100%!
相信上面这些在研药物给了晚期胃癌患者新的希望,同时也能看出,随着新型临床研究的推进,对检测提出了更高要求,需要全面了解患者的基因图谱,已经做了检测的病友可提交病历至全球肿瘤医生网医学部初步评估获得用药方案及临床试验推荐。相信胃癌患者的明天会越来越好。
参考资料:
Li J, Pan H, Liu T, et al. A multicenter, phase 1 study of AB011, a recombinant humanized anti-CLDN18.2 monoclonal antibody, as monotherapy and combined with capecitabine and oxaliplatin (CAPOX) in patients with advanced solid tumors. J Clin Oncol. 2023;41(suppl 4):391. doi:10.1200/JCO.2023.41.3_suppl.391
https://www.onclive.com/view/claudin-18-2-emerges-as-a-novel-therapeutic-target-in-gi-malignancies







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城