中国国产CAR-T细胞疗法技术突飞猛进,攻克血液肿瘤、拿下实体瘤不是梦
现如今,作为肿瘤治疗的第三次革命,免疫治疗是当下肿瘤治疗领域最具前景的发展方向之一。而CAR-T细胞疗法是目前国际最前沿的免疫治疗方法,即从人体血液中提取T细胞,应用基因工程技术将其变身为能识别并消灭肿瘤的CAR-T细胞,再将其输入患者体内。
自从2021年阿基仑赛注射液、瑞基奥仑赛注射液先后在中国获批上市,2022年西达基奥仑赛获美国FDA批准上市,2023年靶向BCMA CAR-T疗法-伊基奥仑赛注射液及靶向CD19的纳基奥仑赛注射液在中国纷纷获批上市,这表示CAR-T疗法已然进入井喷期。
根据国家药审中心及企业公告梳理,人民日报健康客户端的记者发现,目前国内在研的CAR-T产品超过25款,其中包括传奇生物、科济生物、药明巨诺、森朗生物、驯鹿医疗、西比曼生物、信达生物等。
CAR-T疗法在多种血液肿瘤领域,如白血病、淋巴瘤、多发性骨髓瘤等癌种中,表现出不俗的疗效。在实体瘤方面如胃癌、肝癌、结直肠癌等领域也取得了卓越的成绩。今天无癌家园小编就整理下目前国内近期关于CAR-T治疗血液肿瘤、实体瘤的临床研究,以供各位癌友们参考。
CAR-T治疗血液肿瘤
药明巨诺CAR-T产品新适应症拟纳入优先审评,剑指套细胞淋巴瘤
如果说国内首款CAR-T疗法阿基伦赛注射液的获批上市预示着我国迎来CAR-T疗法的井喷时代,那么,2021年9月3日获批上市的中国第2款,全球第6款CAR-T疗法瑞基奥仑赛注射液则将我国的“CAR-T热”推向了一个高潮。
在CAR-T治疗领域取得了巨大成绩的药明巨诺并没有止步不前,2023年11月28日,中国国家药监局药品审评中心(CDE)官网公示,药明巨诺CAR-T产品瑞基奥仑赛注射液一项新适应症拟纳入优先审评,拟用于治疗成人复发或难治性套细胞淋巴瘤(r/r MCL)。
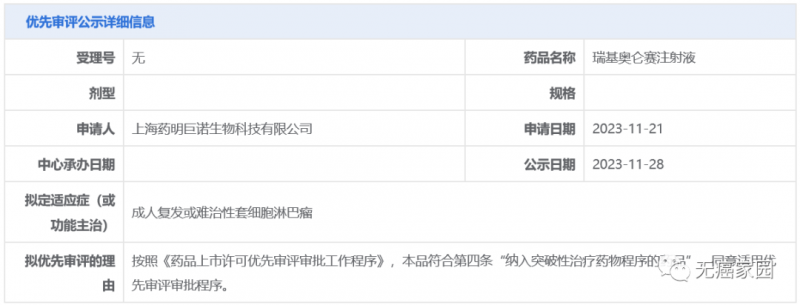
截图源自CDE官网
套细胞淋巴瘤占全部非霍奇金淋巴瘤(NHL)的6%,该病最常见的表现为淋巴结肿大,经常伴随全身症状,近70%的患者在诊断时已是晚期,伴有骨髓和外周血浸润,癌细胞可能扩散至脾脏、肝脏或消化道。但CHOP方案治疗效果差强人意,只有少数患者能够达到完全缓解,因此CAR-T疗法成为套细胞淋巴瘤一种新的治疗选择。
在2022年第64届美国血液学会(ASH)年会上,药明巨诺已公布了瑞基奥仑赛注射液针对r/r MCL的2期临床数据。
截止到2021年11月30日,11例接受至少2线治疗失败的MCL患者的初步数据显示,瑞基奥仑赛治疗的最佳客观缓解率为81.8%,最佳完全缓解率为54.5%,临床疗效良好,治疗相关的不良反应发生率低。
目前急招B细胞淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)、急性淋巴细胞白血病、非霍奇金淋巴瘤、胃癌、肝癌、胰腺癌、结直肠癌、间皮瘤、卵巢癌等癌种!
想要评估病情是否能够接受CAR-T疗法可将病理报告、治疗经历及出院小结等提交至医学部进行初步评估!
我国又一款CAR-T细胞IND获FDA批准,骨髓瘤又添一员猛将
2023年12月4日,科济药业的一款CAR-T细胞产品(CT071)的IND获美国食品药品监督管理局(FDA)批准,该药是一种靶向GPRC5D(G蛋白偶联受体C组5成员)的自体CAR-T细胞产品,用于治疗复发/难治原发性浆细胞白血病(PCL)、复发/难治多发性骨髓瘤(MM)。
GPRC5D正在成为多发性骨髓瘤领域的重要治疗靶点,多发性骨髓瘤是一种常见但不可治愈的血液恶性肿瘤,其特征是浆细胞的无序增殖。GPRC5D在恶性浆细胞表面显著过表达,而在正常组织中的表达有限,使其成为治疗多发性骨髓瘤和浆细胞白血病的理想靶点。目前该药的临床试验(NCT05838131)正在中国开展。
客观缓解率100%!CAR-T疗法BRL-201治疗非霍奇金淋巴瘤疗效显著
2023年11月21日,在第65届美国血液学年会(ASH)上,邦耀生物宣布,其靶向CD19非病毒PD1定点整合CAR-T细胞注射液(代号:BRL-201)治疗复发/难治性B细胞非霍奇金淋巴瘤(R/R B-NHL)的最新临床研究成果。
值得一提的是,CAR-T产品BRL-201是全球首款靶向CD-19非病毒PD1定点整合的CAR-T产品,可在不使用病毒载体的情况相爱,进一步制备获得基因组定点整合的CAR-T产品。相较于传统CAR-T产品的制备,该产品具有成本低、准备时间短、工艺简单、安全性和有效性较高的优势。
在I期临床试验中,纳入25例复发/难治性B细胞非霍奇金淋巴瘤淋巴瘤患者,其中21例接受BRL-201治疗,截至2023年5月17日,中位随访时间为29.0个月,患者客观缓解率(ORR)为100%,最佳缓解为完全缓解(CR),达到85.7%。7例患者在数据截止日期达到并维持完全缓解,其中3例PD-L1表达>50%,1例阴性,3例未知。
此外,所有患者的中位缓解持续时间(DOR)为18.6个月,中位无进展生存期(PFS)为20.8个月,而预估的中位总生存期(OS)尚未达到,12个月总生存期率为76.2%。
结果表明,在复发/难治性B细胞非霍奇金淋巴瘤患者中,BRL-201的疗效较佳,并且安全性是可控的。
CAR-T治疗实体瘤
晚期肝癌患者无癌生存超7年!国研CAR-T疗法突飞猛进
2023年10月12日,科济药业宣布其自主研发的靶向GPC3的CAR-T细胞治疗晚期肝细胞癌(HCC)的两例患者的临床疗效。该临床试验结果刊登在《Cancer Communications》上,2例晚期肝细胞癌患者在入组时合并下腔静脉癌栓,其中1例伴有腹膜后淋巴结转移,预后治疗结局不理想。

▲截自《Cancer Communications》
在临床试验中,一名患者接受肝内复发肿瘤和下腔静脉癌栓局部治疗(微波消融和伽马刀)后,接受了靶向GPC3蛋白的CAR-T细胞治疗,半年后AFP(甲胎蛋白)降至正常水平,影像学复查未见明显活性肿瘤。另一名患者通过局部治疗(微波消融和伽马刀)控制了肝内肿瘤、下腔静脉癌栓和腹膜淋巴结转移瘤,同时接受了CAR-T细胞治疗。
令人欣喜的是,这两例患者在经局部治疗联合CAR-T细胞输注后效果显著,在长期随访期间均呈无瘤状态,两人无瘤生存已超过7年。在整个随访期间,两例患者只接受了口服抗乙肝病毒药物治疗,没有接受其他癌症治疗。
肿瘤病灶完全消失或大幅缓解,CT041挑战胰腺癌效果惊艳
2023年9月21日,科济药业宣布该公司自主研发的靶向Claudin18.2的CAR-T细胞CT041治疗转移性胰腺癌的两个病例报告已发布在9月9日的《血液学与肿瘤学杂志》期刊上。
值得一提的是,这两则典型病例很具有代表性,全部都是化疗失败、全身转移、经历过一二线治疗失败的难治性胰腺癌患者。在参加实体瘤CAR-T疗法CT041临床试验后,均得到不同程度的肿瘤病灶大幅度缩小,甚至完全消失!再次印证了这款里程碑式CAR-T疗法的惊艳疗效!

▲截自《Journal of Hematology & Oncology》
初步临床疗效优于标准疗法!斯丹赛实体瘤CAR-T直击结直肠癌
在2023年10月22日举行的欧洲肿瘤年会(ESMO)上,上海斯丹赛生物公司将以壁报的形式汇报GCC19CART的最新数据。
会上,斯丹赛将做基于自主研发的CoupledCAR®平台技术开发的首发候选产品GCC19CART的报告,该产品被开发用于治疗复发/难治性结直肠癌(R/R mCRC)患者。
2022年4月19日,上海斯丹赛生物宣布,其开发的实体瘤CAR-T产品GCC19CART被美国食品和药物管理局(FDA)授予快速通道资格。
GCC19CART是一款自体CAR-T治疗产品,是用于治疗复发难治转移型结直肠癌(R/R mCRC)的实体肿瘤领先疗法。不得不说,这项殊荣让CAR-T疗法在攻克实体瘤的道路上又迈出了坚实的一步,可喜可贺!
何谓复发难治型结直肠癌?美国国家综合癌症委员会(NCCN)认定的定义为:经多线标准治疗无效或发展转移的患者,这类患者只有极少的有效治疗选项。简而言之这类患者均经过多次常规治疗后无效,几乎没有治愈的可能。而美国最新的统计数据显示,复发难治转移型结直肠癌三线治疗的客观缓解率为1%~1.6%,总中位数生存期仅为6.4~7.1个月,有大批的患者未得到满足的医疗需求。
GCC19CART专门靶向并清除表达结直肠癌肿瘤标记物GCC的癌细胞。公开资料显示,靶向鸟苷酸环化酶C(guanylyl cyclase C,GCC/GUCY2C)属于受体鸟苷酸环化酶家族中的一员,是鸟苷酸、尿鸟苷酸和大肠杆菌肠毒素的受体,在胃肠道的液体和离子稳态中起关键作用。大约80%的结直肠癌患者肿瘤中GCC表达阳性。GCC在正常组织中的表达仅限于肠道内腔上皮细胞顶端,不在其他组织器官中表达,近年来研究发现,GCC在原发性结直肠癌细胞中稳定表达,而在转移性结直肠癌细胞中异常高表达,被认为是转移性结直肠癌的特异性标志分子之一。
据无癌家园小编获悉,在此次ESMO会议上,斯丹赛将会重点介绍来自中国5家临床中心2个剂量爬坡试验组21例患者的数据,验证了GCC19CART产品的安全性和初步疗效。其中13例患者以1级剂量(1x106 cells/kg)入组,8例患者以2级剂量(2x106 cells/kg)入组。
根据实体肿瘤疗效评价标准(RECIST1.1),两种剂量水平的总体客观缓解率(ORR)为28.6%(6/21),即21例受试者中有6例通过治疗后观察到肿瘤体积缩减达到30%;1级剂量组客观缓解率(ORR)为15.4%(2/13),2级剂量组客观缓解率为50%(4/8)。中剂量组的中位随访时间(mOS)已经超过24个月,明显优于FDA批准的标准疗法的三线药物(mOS仅为6-8个月)。该项研究的初步结果显示,GCC19CART在复发/难治性转移性结直肠癌患者中显示出与剂量相关的良好的临床初步疗效以及可控的安全性。
中国CAR-T细胞临床试验进入井喷期,或弯道超车
美国临床试验数据库Clinicaltrials数据显示,截至11月10日,中国CAR-T细胞疗法临床研究数量达到655个,居世界第一,这也是中国首次在一个新药研发领域走到国际前列。其中,传奇生物的西达基奥仑赛、科济药业的Claudin18.2 CAR-T都达到全球领先水平。此外,还有多公司在布局新一代CAR-T以及异体CAR-T技术,初步数据优异,有望获得全球市场。
2021年我国迎来了细胞免疫治疗的元年,作为先锋的CAR-T疗法,是未来发展方向之一。CAR-T疗法主要在于改造T细胞来使其识别肿瘤细胞的特殊靶点,理论上,可以有无数种针对不同靶点的CAR-T疗法,这意味着蕴含着无限可能。
希望不久的将来,能够在国内外医学科研工作者的努力下,降低细胞疗法毒副作用,降低价格,突破实体瘤的瓶颈,让越来越多的晚期癌症患者获益!
参考文献
1.https://www.cde.org.cn/main/xxgk/listpage/2f78f372d351c6851af7431c7710a731
2.https://jhoonline.biomedcentral.com/articles/10.1186/s13045-023-01491-9
3.https://www.cell.com/molecular-therapy-family/molecular-therapy/fulltext/S1525-0016(23)00497-5
4.https://onlinelibrary.wiley.com/doi/10.1002/cac2.12472







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城