2024年3月14日FDA批准PD-1抑制剂替雷利珠单抗注射液(百泽安、Tislelizumab-jsgr、Tevimbra)用于不可切除或转移性食管鳞状细胞癌
2024年3月14日,百济神州宣布其PD-1抑制剂替雷利珠单抗注射液(百泽安、Tislelizumab-jsgr、Tevimbra)获得了FDA的批准,单药用于治疗既往接受过全身化疗(未包含PD-1或PD-L1类疗法)且患有不可切除或转移性食管鳞状细胞癌的成人患者。这是该药物在美国市场获得的首个适应证,此次批准是基于RATIonALE 302研究的积极结果,该研究展示了替雷利珠单抗相比传统化疗在总生存期(OS)、无进展生存期(PFS)和客观缓解率(ORR)等方面的显著优势。

一、获批依据
1.RATIonALE 302研究概述
RATIonALE 302是一项全球性的3期随机对照试验,共纳入来自11个国家和地区的512例患者,研究比较了替雷利珠单抗与标准化疗(紫杉醇、多西他赛或伊立替康)在二线治疗不可切除、局部晚期或转移性ESCC患者中的疗效和安全性,主要研究终点是总人群的总生存期(OS),次要终点包括PD-L1联合阳性评分(CPS)≥10%人群的OS、无进展生存期(PFS)、客观缓解率(ORR)等。
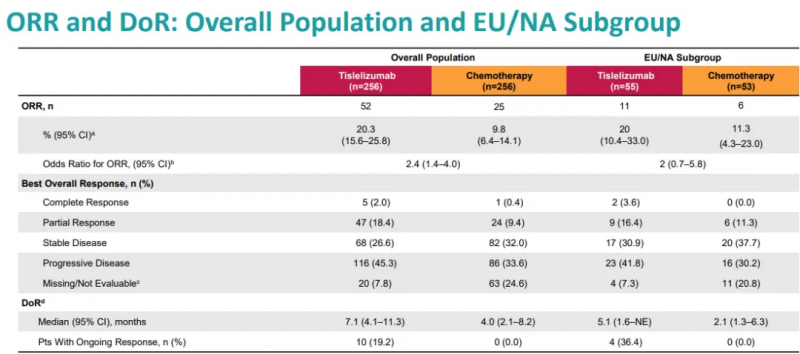
替雷利珠单抗组VS.化疗组的ORR和DoR
2.生存获益分析
研究结果显示,替雷利珠单抗组的中位OS为8.6个月,而化疗组为6.3个月,死亡风险下降了30%;在CPS≥10%的患者群体中,替雷利珠单抗的中位OS更是达到了10.3个月,相较于化疗组的6.8个月,死亡风险下降近50%;此外,替雷利珠单抗组的6个月和12个月OS率均优于化疗组。
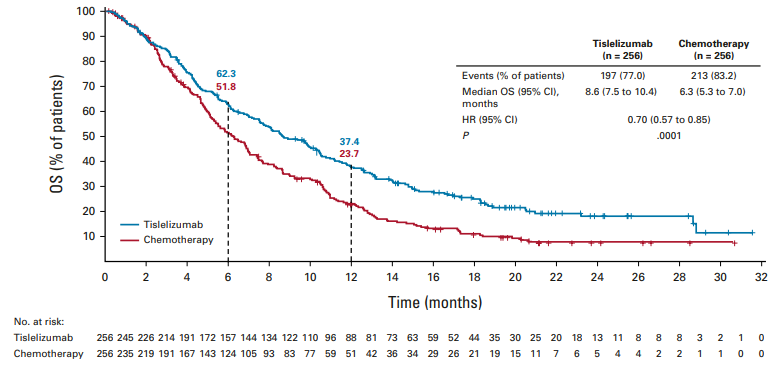
RATIONALE-302研究总人群的OS
3.安全性评估
在安全性方面,替雷利珠单抗展现出良好的耐受性,最常见的不良反应包括血糖升高、血红蛋白降低等,但这些不良反应的发生率与传统化疗相当甚至更低,这表明替雷利珠单抗在提高治疗效果的同时,并未增加患者的不良事件风险。
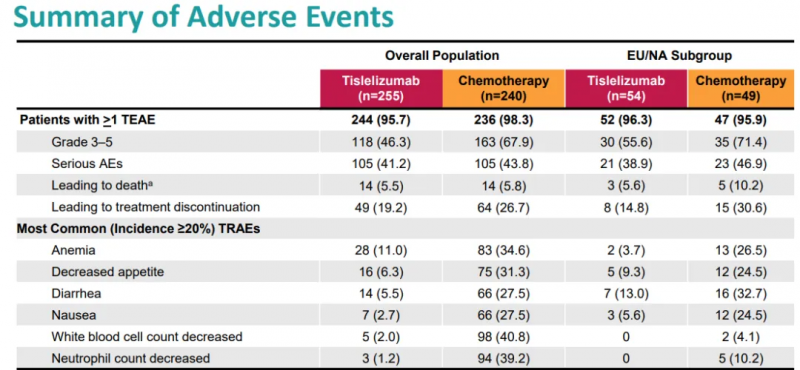
替雷利珠单抗的安全性
二、作用机制与科学原理
PD-1/PD-L1通路与肿瘤免疫逃逸
替雷利珠单抗作为PD-1抑制剂,其核心作用机制在于阻断PD-1与其配体PD-L1之间的相互作用,在正常情况下,PD-1/PD-L1通路是免疫系统的一种自我调节机制,用于防止过度激活导致的自身免疫反应;然而,在肿瘤微环境中,肿瘤细胞会利用这一通路来逃避免疫系统的监视与攻击,即“肿瘤免疫逃逸”,通过抑制PD-1,替雷利珠单抗能够解除这种抑制,恢复T细胞的活性与功能,从而激发机体对肿瘤细胞的免疫应答。
独特的分子结构与生物活性
替雷利珠单抗在分子结构上进行了优化,以确保其更强的结合能力和更低的免疫原性,这种设计不仅提高了药物的疗效,还减少了不良反应的发生,此外,替雷利珠单抗还展现出了良好的药代动力学特性,确保了药物在体内能够稳定发挥作用。
三、在美国的获批经历
替雷利珠单抗(Tislelizumab,商品名Tevimbra)在美国的获批经历是一个充满挑战与突破的过程,以下是其在美国的主要获批经历概述:
初步申请与延期
生物制品许可申请(BLA)提交:2021年9月,替雷利珠单抗的生物制品许可申请(BLA)被美国食品药品监督管理局(FDA)接受,旨在作为既往全身治疗后不可切除复发性局部晚期或转移性食管鳞状细胞癌(ESCC)患者的潜在治疗选择。
审批延期:不幸的是,由于COVID-19疫情带来的旅行限制,FDA在2022年7月推迟了对该BLA的审批。这一延期对替雷利珠单抗的上市时间造成了影响。
后续进展与批准
重新提交与审查:2023年9月,FDA根据Ⅲ期RATIonALE 306研究(NCT03783442)的数据,重新接受了对替雷利珠单抗的BLA审查,此次审查寻求批准替雷利珠单抗用于不可切除、复发性、局部晚期或转移性ESCC患者的一线治疗。
临床试验数据支持:RATIonALE 306研究数据显示,在化疗中加用替雷利珠单抗治疗这类ESCC患者的中位总生存期(OS)为17.2个月,而安慰剂加化疗组为10.6个月,显示出显著的生存优势(分层HR:0.66;95%CI:0.54~0.80;P<0.0001)。
首次单药疗法获批:2024年3月14日,百济神州(BeiGene)宣布,FDA已批准替雷利珠单抗作为单药疗法,用于治疗既往接受过全身化疗(不包括PD-1或PD-L1类疗法)的、患有不可切除或转移性ESCC的成年患者,这是替雷利珠单抗在美国的首次获批,标志着其在ESCC治疗领域的重要里程碑。
未来展望
一线治疗评估:除了已获批的单药疗法外,FDA还在评估替雷利珠单抗作为一线疗法,用以治疗不可切除、复发、局部晚期或转移性ESCC患者的监管申请,这一审评预计将在2024年7月获得结果。
扩展适应症:FDA同时也在评估替雷利珠单抗用于治疗局部晚期不可切除或转移性胃或胃食管交界处(G/GEJ)腺癌患者的监管申请,该审评预计将在2024年12月获得结果。
替雷利珠单抗在美国的获批经历展示了其在肿瘤免疫治疗领域的潜力和价值,也为更多患者带来了新的治疗希望和选择,随着更多临床试验数据的积累和监管审批的推进,替雷利珠单抗的适应症和应用范围有望进一步拓展。
四、结语
替雷利珠单抗的FDA获批,是肿瘤免疫治疗领域的一次重要突破,为不可切除或转移性ESCC患者带来了新的治疗选择和希望,我们期待看到更多关于替雷利珠单抗的临床研究数据,以进一步验证其疗效与安全性,并推动其在更多肿瘤类型中的应用。







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城