四款CAR-T疗法纳入医保初审目录
越来越多的临床试验,已彰显出CAR-T疗法在恶性肿瘤,尤其是血液肿瘤领域的有效性及安全性。在全球3000多种在研的细胞疗法药物中,CAR-T疗法占据了“半壁江山”。近年来,我国CAR-T细胞疗法的研发热度空前高涨,我国也超越美国成为了CAR-T疗法临床研究的中坚力量。除了临床研究的大幅度增长外,还有多款产品相继问世。
除了刚刚获得药监局批准的西达基奥仑赛外,2023年6月获批上市的伊基奥仑赛注射液,更是让总体缓解率飙升至96%!此外,在近期提交的医保初审名单中,有四款CAR-T产品赫然在列,这也意味着CAR-T这款“天价”的抗癌新技术,离患者更近一步了!
伊基奥仑赛注射液:中国首个BCMA CAR-T,总体缓解率高达96%
伊基奥仑赛注射液(福可苏®,Equecabtagene Autoleucel Injection,CT103A)是由驯鹿生物与信达生物及合作研发的一款靶向BCMA的CAR-T细胞疗法。2023年6月30日获中国国家药品监督管理局(NMPA)批准上市,用于复发/难治性多发性骨髓瘤(R/R MM)的治疗。值得一提的是,伊基奥仑赛注射液是中国首款获批的BCMA CAR-T产品,同时也是全球首款全人源靶向BCMA CAR-T疗法!
▲截图源自“NMPA”
在中国进行的FUMANBA-1临床研究,共入组103名复发或难治性多发性骨髓瘤患者(中位年龄为58岁),这些患者既往接受过包括至少1种免疫调节剂+1种蛋白酶体抑制剂在内的≥3线治疗。
入组接受伊基奥仑赛注射液回输治疗后,在101位可评估疗效的患者中,结果显示:总体缓解率(ORR)高达96.0%(97/101)!严格意义的完全缓解/完全缓解率(sCR/CR)为74.3%(75/101),12个月中位无进展生存期(PFS)率达78.8%(95% CI: 68.6–85.97)。
纳入医保初审目录的四款CAR-T疗法
1、阿基仑赛注射液
阿基仑赛注射液(FKC876,奕凯达®)是由复星凯特生物公司研发的一款靶向CD19的CAR-T细胞产品,2021年6月22日,获中国国家药监局(NMPA)批准上市,用于治疗成人复发或难治性(R/R)大B细胞淋巴瘤,它是我国第1个获批上市的CAR-T疗法
研究显示,阿基仑赛注射液治疗复发难治性非霍奇金淋巴瘤,12个月总生存(OS)率高达84.3%,最佳总缓解率达83.2%,最佳完全缓解率(CRR)达58.4%。
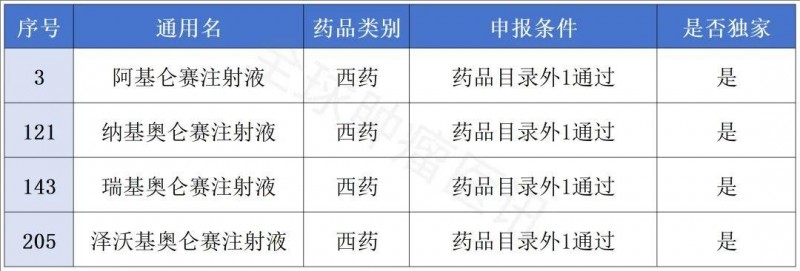
▼通过初步形式审查的目录外药品名单
2、纳基奥仑赛注射液
纳基奥仑赛注射液(CNCT19细胞注射液,Inaticabtagene Autoleucel Injection,源瑞达®)是由合源生物研发的一款CAR-T细胞产品,国家药监局(NMPA)于2023年11月8日批准其上市,用于成人复发或难治性B细胞急性淋巴细胞白血病(r/r B-ALL)的治疗,它是我国初代治疗白血病的CAR-T细胞产品。
第64届美国血液学年会(ASH)上公布的关键性临床研究结果(NCT04684147)显示,入组的39例复发或难治性B细胞急性淋巴细胞白血病患者,总体缓解率(ORR)分别为82.1%(治疗3个月内) vs 64.1%(治疗3个月时)。
3、瑞基奥仑赛注射液
瑞基奥仑赛注射液(relma-cel,倍诺达®)是由药明巨诺研发的一款CD19 CAR-T细胞产品,2021年9月1日获中国国家药监局(NMPA)批准,用于治疗二线或以上系统治疗失败的成人复发或难治性大B细胞淋巴瘤(r/r LBCL)。它是我国获批的第2款CAR-T产品!
在2020年美国血液学会(ASH)年会上,公布的数据显示,治疗3个月的客观缓解率(ORR)达到58.6%,治疗6个月的无进展生存(PFS)率为54.2%,中位总生存(OS)率高达90.8%!
▼55例可评估疗效患者,根据SPD的肿瘤体积相对于基线的变化
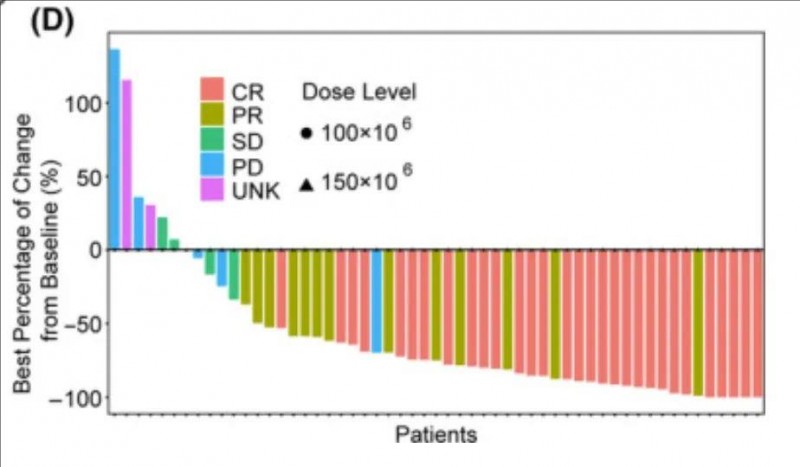
▲图源“Cancer Med”,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
4、泽沃基奥仑赛注射液
泽沃基奥仑赛(赛恺泽®,zevor-cel,Zevorcabtagene Autoleucel,产品编号CT053),是由科济药业研发的一款自体BCMA靶向的CAR-T细胞产品。2024年3月1日,国家药品监督管理局批准了其新药上市申请,用于治疗复发或难治性多发性骨髓瘤(R/R MM)。它是我国上市的第5款CAR-T细胞产品!同时也是第2款BCMA靶向的CAR-T细胞产品!
LUMMICAR STUDY 1临床研究显示,中位PFS达25.0个月,21.4%的患者获得部分缓解(PR),78.6%的患者获得完全缓解(CR)或严格完全缓解(sCR)!
小编寄语
近年来,随着多款CAR-T疗法相继获批上市,我国CAR-T的研发领域也迎来了属于自己的高光时刻!目前我国已有20多家制药巨头,如驯鹿医疗、传奇生物、复星凯特、科济生物等纷纷布局CAR-T的研发,力争在精确调控、新靶点设计、通用CAR-T细胞等方面,取得突破性进展。今年,更是有四款CAR-T产品杀入“医保初审名单”。全球肿瘤医学部小编也期望随着越来越多明星靶点的涌现、技术的不断革新,CAR-T疗法可以早日突破价格和癌症治疗的瓶颈,造福更多的癌症晚期患者,实现长期带瘤生存、降低复发风险的美好愿景!
如果您对目前的治疗方案不满意,或想寻求CAR-T、CAR-NK、TCR-T、TIL疗法等国内外抗癌新技术的帮助,可将治疗经历、近期影像学检查、病理检查报告等资料汇总后,提交至医学部,进行初步评估,或申请国内外抗癌专家会诊。
参考资料
[1]Mi J Q,et al.Phase II, open-label study of ciltacabtagene autoleucel, an anti–B-cell maturation antigen chimeric antigen receptor–T-cell therapy, in chinese patients with relapsed/refractory multiple myeloma (CARTIFAN-1)[J]. Journal of Clinical Oncology, 2023, 41(6): 1275-1284.
https://ascopubs.org/doi/10.1200/JCO.22.00690?url_ver=Z39.88-2003&rfr_id=ori:rid:crossref.org&rfr_dat=cr_pub%20%200pubmed
[2]Ying Z,et al.Relmacabtagene autoleucel (relma-cel) CD19 CAR-T therapy for adults with heavily pretreated relapsed/refractory large B-cell lymphoma in China. Cancer Med. 2021 Feb;10(3):999-1011.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC7897944/
[3]Fu C,et al.Three-Year Follow-up on Efficacy and Safety Results from Phase 1 Lummicar Study 1 of Zevorcabtagene Autoleucel in Chinese Patients with Relapsed or Refractory Multiple Myeloma[J]. Blood,2023, 142(Supplement 1): 4845-4845.
https://www.sciencedirect.com/science/article/abs/pii/S0006497123114467
[4]https://www.nmpa.gov.cn/zwfw/sdxx/sdxxyp/yppjfb/20240827132419122.html







































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城