


2024年6月18日国家药监局批准特瑞普利单抗注射液(拓益、Toripalimab、Loqtorz)联合注射用紫杉醇(白蛋白结合型)用于PD-L1阳性(CPS≥1)的初治转移或复发转移性三阴性乳腺癌
2024年6月18日,中国国家药品监督管理局(NMPA)批准特瑞普利单抗注射液(拓益、Toripalimab、Loqtorz)联合注射用紫杉醇(白蛋白结合型)用于PD-L1阳性(CPS≥1)的初治转移或复发转移性三阴性乳腺癌(TNBC)的治疗。这一消息无疑为众多TNBC患者带来了新的希望和生机。

获批依据
特瑞普利单抗的此次获批主要依据是一项名为TORCHLIGHT的随机、双盲、III 期临床试验,该研究由中国人民解放军总医院江泽飞教授团队牵头,旨在评估特瑞普利单抗联合白蛋白结合型紫杉醇(nab-Paclitaxel简写做nab-P)治疗三阴性乳腺癌患者的疗效和安全性。
临床研究背景
疾病现状:三阴性乳腺癌(TNBC)是乳腺癌的一种特殊亚型,占所有乳腺癌的15-20%,其预后相对较差,治疗选择有限,特别是对于转移性或复发性患者。
现有治疗方案:在免疫治疗出现之前,全身化疗(包括紫杉烷类、蒽环类和/或铂类)是TNBC的一线治疗选择,但效果有限,中位总生存期(mOS)仅为9-12个月,5年生存率约为12%。
入组标准:
研究入组的TNBC患者需满足一系列严格的标准,包括:
●组织学确诊为TNBC。
●既往未经治疗或既往接受过不超过一种全身化疗方案。
●IV期或无法手术的局部晚期TNBC,且无病生存期≥12个月。
●至少有一个可测量病灶。
●ECOG PS评分为0或1分,即患者的体能状况良好,能够进行日常活动。
●器官功能正常,能够耐受治疗。
排除标准:
为确保研究结果的真实性和可靠性,研究排除了部分患者,包括:
●既往接受过抗PD-1/PD-L1/PD-L2/CTLA-4治疗。
●存在活动性或未经治疗的脑转移。
●有活动性自身免疫性疾病。
分组:
●入组患者按2:1的比例随机分配至特瑞普利单抗组(试验组)或安慰剂组(对照组),确保两组患者基线特征均衡,减少偏倚。
治疗方案:
试验组:特瑞普利单抗240mg D1+nab-P 125mg/㎡,D1、D8,每21天为1周期。
对照组:安慰剂D1+nab-P 125 mg/㎡,D1、D8,每21天为1周期。
主要研究结果
无进展生存期(PFS):
●在PD-L1阳性人群中,特瑞普利单抗组的中位PFS显著延长2.8个月(8.4个月 vs 5.6个月),疾病进展或死亡风险降低35%(HR = 0.65,95%CI 0.470-0.906,P = 0.0102)。
●在ITT人群中,特瑞普利单抗组的中位PFS也有所改善(8.4个月 vs 6.9个月,HR = 0.77,95%CI 0.602-0.994,P = 0.0445),但未达预设疗效界值。
总生存期(OS):
●在PD-L1阳性人群中,特瑞普利单抗组的中位OS为32.8个月,对照组为19.5个月,降低死亡风险38%(HR = 0.62,95%CI 0.414-0.914,nominal P = 0.0148)。
●在ITT人群中,特瑞普利单抗组的中位OS为33.1个月,对照组为23.5个月(HR = 0.69,95%CI 0.513-0.932,nominal P = 0.0145)。
缓解持续时间(DoR):
●在PD-L1阳性人群中,特瑞普利单抗组的中位DoR为10.8个月,显著高于对照组的5.6个月。
●在ITT人群中,特瑞普利单抗组的中位DoR为8.5个月,对照组为6.9个月。
安全性:
●试验组和对照组的≥3级治疗突发不良事件(TEAE)和致命性不良事件(AE)发生率相似。
●特瑞普利单抗组的严重AEs、导致停药的TEAEs、免疫相关AEs(irAEs)及≥3级irAEs的发生率较高,但无新的安全信号出现。
研究结论与获批依据
疗效显著:TORCHLIGHT研究表明,特瑞普利单抗联合nab-P在PD-L1阳性(CPS≥1)的转移性或复发性TNBC患者中显著延长了PFS,且OS也呈现出改善趋势。
安全性良好:尽管特瑞普利单抗组的某些不良事件发生率较高,但整体安全性可控,未发现新的安全信号。
临床价值:该研究进一步验证了将PD-1检查点阻断加入化疗中以治疗晚期TNBC的临床价值,为这类患者提供了新的治疗选择。
综上所述,基于TORCHLIGHT研究的显著疗效和良好的安全性,特瑞普利单抗联合注射用紫杉醇(白蛋白结合型)被中国国家药监局(NMPA)批准用于PD-L1阳性(CPS≥1)的初治转移或复发转移性三阴性乳腺癌的治疗,这一批准将为更多TNBC患者提供新的治疗选择,有望改善患者的预后和生活质量。
2. 备注【癌种】申请方舟援助计划


患者咨询电话:400-666-7998

全球肿瘤医生网提醒患者:国内细胞免疫治疗技术,包括cart细胞,树突细胞疫苗,NK细胞
TILs细胞,TCR t细胞治疗癌症疫苗等技术均处于临床试验阶段,未获准在医院正式使用。国内患者可以参加正规临床试验,在医生的监管下使用,全球肿瘤医生网不推荐患者贸然尝试任何医疗机构和研发机构的收费治疗。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。

-

-
肿瘤电场疗法——被FDA批准治疗复发性胶质母细胞瘤等
目前电场疗法已被FDA批准用于治疗复发性胶质母细胞瘤、新诊断的胶质母细胞瘤以及恶性胸膜间皮瘤,并且在目前在六大实体肿瘤包括非小细胞肺癌 详细»
-

-
临床试验中心——每一个新药都是一份希望
提供癌症临床试验招募信息、抗肿瘤新药受试者招募信息。 详细»
-

-
2024年6月18日国家药监局批准特瑞普利单抗注射液(拓益、Toripalimab、Loqtorz)联合注射用紫杉醇(白蛋白结合型)用于PD-L1阳性(CPS
2024年6月18日,中国国家药品监督管理局(NMPA)批准特瑞普利单抗注射液(拓益、Toripalimab、Loqtorz)联合注射用紫杉醇(白蛋白结合型)用于PD-L1阳性(CPS≥1)的初治转移或复发转移性三阴性乳腺癌(TNBC)的治疗。 详细»
-
-
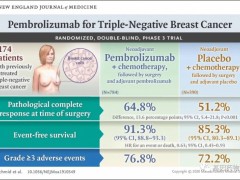
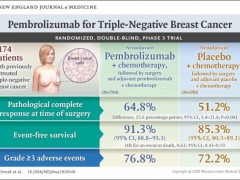
速递|三阴乳腺癌新辅助治疗,派姆单抗获批用于三阴乳腺癌新辅助疗法和三阴乳腺癌辅助疗法
2021年7月27日,FDA再次批准了派姆单抗的三阴性乳腺癌新适应症,分别用于辅助及新辅助治疗。 详细»
-
-
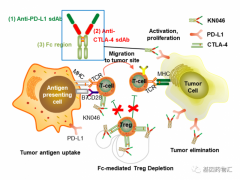
中国国产原研第二代免疫双抗药,双特异性抗体药物KN046联合白蛋白紫杉醇治疗转移性三阴性乳腺癌患者无进展生存7.3个月
本届AACR年会上,我国自主研发的免疫“双抗”KN046联合白蛋白紫杉醇治疗转移性三阴性乳腺癌患者的疗效公开,令人惊艳。 详细»
-

-
乳腺癌免疫疗法,四大乳腺癌免疫治疗方案能否扛起2021年乳腺癌治疗的大旗
免疫疗法被誉为癌症治疗的“第三次革命”,为包括乳腺癌在内的各癌症的治疗带来了革命性的变革。 详细»
-
-
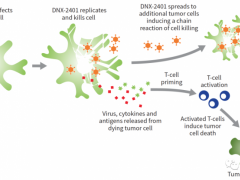
乳腺癌最新疗法,溶瘤病毒疗法治疗成为治疗乳腺癌的新武器
免疫疗法被誉为癌症治疗的“第三次革命”,通过诱导、增强或抑制免疫反应治疗疾病。 详细»
-
-
三阴乳腺癌新药,三阴乳腺癌免疫治疗(pd1)药物K药获FDA首批
2020年11月13日,美国食品药品监督管理局(FDA)批准了加速批准了默沙东(MSD)重磅PD-1抑制剂K药与化疗联用。 详细»
-

-
三阴乳腺癌免疫治疗成功案例
它被称为阿特珠单抗(也称为MPDL3280A,由Roche / Genentech制造),属于检查点抑制剂的免疫疗法。 详细»
-

-
三阴乳腺癌免疫治疗,三阴乳腺癌新药,三阴乳腺癌免疫疗法(PD-1/PD-L1)新药力挽狂澜
无进展生存期延长一半、客观缓解率53%,免疫疗法是怎样改变三阴性乳腺癌患者的治疗标准的? 详细»































 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城