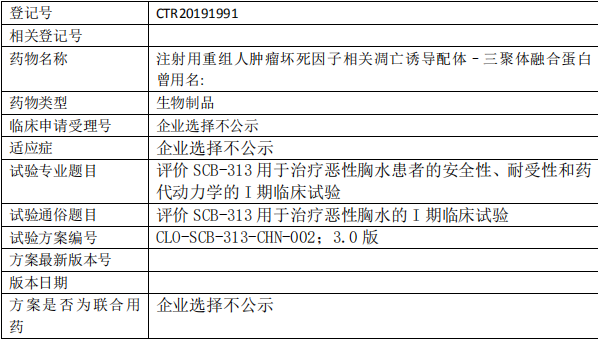
SCB-313临床试验,评价 SCB-313 用于治疗恶性胸水的I期临床试验
1、试验目的
1)通过一次胸腔注射给药的方式,评估 SCB-313 的单次给药的安全性和耐受性;
2)通过每天一次胸腔注射给药,连续给药 3 天的方式,评估 SCB-313 的重复给药的安全性和耐受性,确定 SCB-313 的最大耐受剂量(MTD)。
2、试验设计
试验分类:安全性和有效性
试验分期:I 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 75 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.经组织病理学或细胞病理学证实患有晚期恶性实体肿瘤。
2.经组织病理学或细胞病理学证实伴有需引流的恶性胸水。
3.ECOG 体能状态评分:0 到 2。ECOG 评分为 3 分的患者,如果研究者确定去除胸腔积液可以使他们的体能状态评分降到 2 或以下,则可纳入。
4.预期寿命至少 8 周。
5.18 周岁≤年龄≤75 周岁。
6.体重 ≥ 45 kg,且体重指数 ≥ 17 kg/m2。
7.尚可的血液功能,定义为:
a) 血小板计数 ≥ 80,000 /μL;
b)凝血酶时间和激活部分凝血酶时间 ≤ 1.5 倍正常值上限(ULN);
c) 绝对中性粒细胞计数 ≥ 1,500 /μL;
d) 血红蛋白 ≥ 8 g/dL(允许输血和使用红细胞生成剂)。如果存在活动性出血或其它持续状况导致红细胞破坏增加或产生受损,可能需要反复输血或红细胞治疗,患者入组之前,必须根据具体情况与申办方讨论其入组资格;
e) 白蛋白≥35g/L。
8.尚可的肾功能,定义为血清肌酐 ≤ 2.0 倍 ULN 且肌酸清除率 >50 mL/分钟。
9.尚可的肝功能,定义为:
a)丙氨酸转氨酶(ALT)和天冬氨酸转氨酶(AST)≤ 2.0 倍 ULN(若存在肝转移,则可≤ 5x ULN);
b)胆红素 ≤ 2.0 倍 ULN,除非患者患有吉尔伯特综合症。
10.有生育力的女性患者(不包括接受过外科绝育手术或绝经的妇女,定义为因非医学原因致 1 年或 1 年以上无月经)符合条件的情况是:她们在首次使用 SCB-313 前 7 天血清妊娠测试结果为阴性且愿意使用有效的节育/避孕方法来防止怀孕,直到停用SCB-313 后 6 个月; 在研究期间和停用 SCB-313 后 6 个月内,具有生殖力的男性和女性都必须同意使用有效的避孕方法; 注意:被视为高效避孕的方法如下:完全节欲、子宫环、双重屏障法(如避孕套加上带杀精剂的隔膜)、埋植避孕药、激素类避孕用品(避孕药、植入物、透皮贴剂、荷尔蒙阴道装置或延长释放的注射剂),或行输精管切除术后被证实精子缺乏的伴侣。
11.愿意参加试验方案所规定的定期随访。
排除标准
1.分隔严重且不适合引流的胸腔积液,患者不大可能受益于胸腔治疗。
2. 受试者已经稳定使用的系统性抗肿瘤治疗之外的任何抗肿瘤药物及对胸水的控制可能产生作用的任何治疗;对已经停止的单克隆抗体治疗,应经研究者的判断,确保延迟的副作用不会影响SCB-313 治疗后的 DLT 评估期。
3. 入组前 2 周内患有急性或慢性感染(如肺结核),且需要使用抗病毒或静脉注射抗生素治疗。
4. 合并临床不稳定或无法控制的血液、心血管、肺、肝、肾、胰腺或内分泌疾病。5. 入组前 3 个月内有大咯血病史(> 2.5 mL)。
6. 伴有前期治疗未恢复的 > 2 级的不良事件(AEs)。
7. 证实或怀疑患有相关精神损害,包括酗酒或滥用毒品。
8. 治疗前 6 个月内发生过心肌梗塞和/或既往诊断为充血性心力衰竭(纽约心脏协会 III 级或 IV 级);不稳定心绞痛;需要药物治疗的不稳定心律失常和/或长QT综合征或基线水平的QT/QTc间隔 > 450 msec。
9. 控制不佳的高血压,定义为经反复测量确认,收缩压 ≥ 160mmhg 和/或舒张血压 ≥ 100 mmhg(注意:重复测量不得超过3次)。
10. 入组前 4 周内进行大手术(开腹、开腔手术)。
11. 筛选前 30 天出现过肠梗阻。
12. 有人类免疫缺陷病毒(HIV)抗体阳性史,或在筛查时 HIV 血清学测试阳性阳性的患者;梅毒抗体阳性者;有活动性乙型肝炎感染的患者,即乙肝表面抗原(HBsAg)阳性和/或乙肝核心抗体(HBcAb)阳性且乙肝病毒的脱氧核糖核酸(HBV DNA)> 检测下限;丙型肝炎(HCV)病毒抗体血清阳性的患者,除非在筛查前24 周内有 2 个 HCV RNA 阴性检测结果,并且在筛查时有第三个 HCV RNA 阴性检测结果。
13. 入组前两周内接种过活疫苗。
14. 本研究过程中,已计划参加另一项试验药物或设备的临床研究。
15. 既往接受过以基于 TRAIL 或死亡受体 4/5 激动剂的治疗。
16. 已知或怀疑对 SCB-313 的任何成分过敏。
17. 研究者认为受试者存在任何临床或实验室检查异常或其他原因而不适合参加本临床研究。
18. 患有未经治疗的或未控制的或不稳定的中枢神经系统转移性疾病、软脑膜疾病或脊髓压迫症。
研究者信息
1、主要研究者信息
姓名:王永生
学位:医学博士
职称:主任医师
单位名称:四川大学华西医院
2、各参加机构信息
机构名称:四川大学华西医院
(主要)研究者:王永生
国家:中国
省(州)-城市:四川 -成都




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城