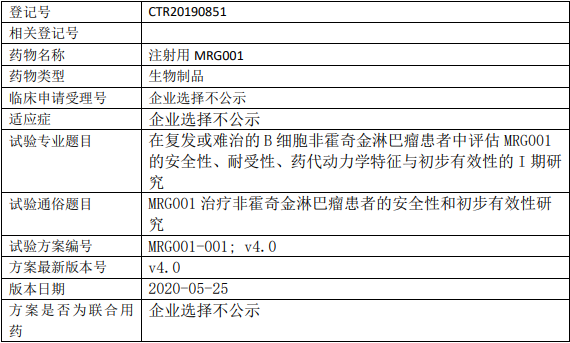
MRG001临床试验,CD20靶向药MRG001治疗非霍奇金淋巴瘤患者的安全性和初步有效性研究
1、试验目的
确定MRG001在复发或难治的B细胞非霍奇金淋巴瘤患者中的安全性和耐受性,并初步评估抗肿瘤活性。同时评估MRG001的药代动力学特征,及患者对 MRG001的免疫原性。
2、试验设计
试验分类:安全性和有效性
试验分期:I 期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 75 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.预期寿命≥3 个月
2.必须经过含抗 CD20 抗体标准治疗后的 CD20 阳性复发或难治B细胞非霍奇金淋巴瘤
3.至少存在一个既往未经局部治疗的可测量病灶
4.ECOG 评分为 0 至 1 分
5.无严重器官功能异常
6.女性未怀孕,且所有患者在研究期间采取避孕措施
7.自愿签署参加本临床试验的书面知情同意书,并遵守研究规定的要求
排除标准
1.过敏体质或对 MRG001 任一组分有过敏史
2. 可疑或确认的中枢神经系统侵犯的非霍奇金淋巴瘤
3. 在筛选前 3 个月内接受过 CD20 靶向治疗
4. 已知的丙型肝炎、慢性活动性乙型肝炎或非病毒性肝炎病史
5. 已知的人类免疫缺陷病毒感染
6. 有任何严重的和/或不可控制的疾病
7. 筛选前 6 周内进行过重大手术,或拟在接受给药后第一个12周进行重大手术
8. 筛选前 28 天内正在接受任何批准的或试验性的放疗、化疗、小分子靶向药物、中成药或中草药的抗肿瘤治疗,或其他任何试验性的临床研究治疗;或者筛选前 3 个月内参加过任何批准的或试验性的抗体药物和 CAR-T 等抗肿瘤治疗
9. 曾接受过异体干细胞移植,筛选前 3 个月内接受过自体干细胞移植,或拟进行自体干细胞移植
10. 妊娠期或哺乳期患者
研究者信息
1、主要研究者信息
姓名:朱军/宋玉琴
学位:医学博士
职称:主任医师
单位名称:北京大学肿瘤医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-城市 |
| 1 | 北京大学肿瘤医院 | 朱军/宋玉琴 | 中国 | 北京市 -北京市 |
| 2 | 上海市东方医院 | 郭晔 | 中国 | 上海市 -上海市 |
| 3 | 河南省肿瘤医院 | 周可树 | 中国 | 河南省 -郑州市 |
| 4 | 首都医科大学附属北京友谊医院 | 王昭 | 中国 | 北京市 -北京市 |
| 5 | 浙江省肿瘤医院 | 杨海燕 | 中国 | 浙江省 -杭州市 |
| 6 | 中国医科大学附属盛京医院 | 刘卓刚 | 中国 | 辽宁省 -沈阳市 |
| 7 | 福建医科大学附属协和医院 | 胡建达 | 中国 | 福建省 -福州市 |
| 8 | 福建省肿瘤医院 | 杨瑜 | 中国 | 福建省 -福州市 |
| 9 | 南方医科大学珠江医院 | 李玉华 | 中国 | 广东省 -广州市 |
| 10 | 中山大学附属肿瘤医院 | 蔡清清 | 中国 | 广东省 -广州市 |
| 11 | 哈尔滨市第一医院 | 马军 | 中国 | 黑龙江省 -哈尔滨市 |
| 12 | 广东省人民医院 | 李文瑜 | 中国 | 广东省 -广州市 |
| 13 | 中国医科大学附属第一医院 | 颜晓菁 | 中国 | 辽宁省 -沈阳市 |




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城