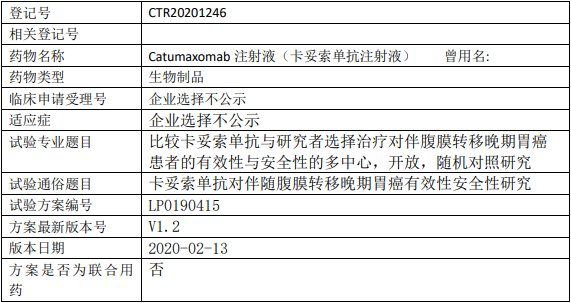
卡妥索单抗临床试验,卡妥索单抗注射液(Catumaxomab)抗对伴随腹膜转移晚期胃癌有效性安全性研究
1、试验目的
主要目的:比较伴腹膜转移的晚期胃癌患者接受腹腔灌注卡妥索单抗与研究者选择治疗的疗效和安全性。
次要目的:评估腹腔灌注卡妥索单抗的安全性。 评估腹腔灌注卡妥索单抗的药代/药效动力学特征
2、试验设计
试验分类:安全性和有效性
试验分期:其它Ⅰ/Ⅲ期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
3、受试者信息
年龄:18 岁(最小年龄)至 100 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.提供已签署并注明签署日期的知情同意书
2.表明在研究期间遵守所有研究程序的意愿及依从性
3.男性或女性,年龄在签署知情同意书时不少于 18 岁
4.组织学或细胞学证实为胃腺癌
5.根据 RECIST V1.1 标准,有可评价或不可评价病灶
6.诊断胃癌合并腹膜转移(影像学结果或既往手术病理或腹水/腹腔积液细胞学检查阳性)
7.至少接受过两线针对复发或转移性胃癌的标准的全身性抗肿瘤方案治疗后治疗失败
8.患者已从既往使用药物的任何毒性反应中恢复(根据NCI-CTCAEv 5.0 判定为 0-1 级)
9.预计生存期≥3 月
10.东部肿瘤协作组(ECOG) 活动状态 0-2
11.ANC (绝对中性粒细胞计数)≥ 1.5 × 10^9/L;血红蛋白≥ 80g/L;血小板≥ 100 × 10^9/L;淋巴细胞比例≥13%;血清胆红素≤ 1.25 x ULN(或 2.5 x ULN 如有 Gilbert 综合症);AST 和 ALT≤2.5 × ULN 无肝转移 ≤ 5 × ULN 如有肝转移;血清肌酐计算的肌酐清除率≤ 2.0 mg/dL 或 ≥30 mL/min
12.对于具有生殖潜力的女性:至少筛选前 1 个月使用医学上认可的避孕措施,并同意从筛查期到末次腹腔灌注后 30 天内使用这种方法进行避孕
13.对于具有生殖潜力的男性:从筛查期到末次腹腔灌注后 30 天内使用医学上认可的避孕措施进行避孕.
排除标准
1.已知或疑似对卡妥索单抗或类似抗体过敏
2. 既往接受抗肿瘤治疗,包括:其他抗肿瘤临床研究药物,化学疗法、免疫疗法、生物制剂、激素疗法、放射疗法(缓解疼痛的局部放射疗法除外)等,末次治疗日期距首次腹腔灌注日期≤21天
3. 有广泛的肝转移(经影像学检查肿瘤体积预计占肝脏总体积比例≥50%)
4. 已知的肿瘤颅内转移
5. 首次灌注前 3 天下列疾病尚未缓解到 CTCAE 0-1 级:未控制的急、慢性感染,例如:肺炎、胆道感染、乙型肝炎病毒感染和丙型肝炎病毒感染等;急性或慢性胰腺炎;腹泻;呼吸困难
6. NYHA 评级 3 或 4 级
7. 相关心血管疾病的症状以及体征:包括心肌梗死、充血性心力衰竭、心律失常等8. 已知的脑血管意外事件
9. 首次给药前 30 天内曾出现肠梗阻
10. 影像学诊断门静脉阻塞,包括肿瘤压迫或门脉内血栓、癌栓等
11. 自身免疫性疾病史(例如:炎症性肠病,特发性血小板减少性紫癜,系统性红斑狼疮,自身溶血性贫血,类风湿性关节炎等)
12. 已知 HIV 血清学阳性、丙型肝炎感染和/或乙型肝炎(HepBsAg或核心抗体阳性并且接受针对乙型肝炎的抗病毒治疗后有反应的患者除外:这些患者允许参与本研究;备注:筛选时 HepBsAg 阴性的患者,或筛选时正在接受干扰素-2a [IFN] 或聚乙二醇干扰素-2a [Peg-IFN] 治疗且乙型肝炎病毒 [HBV] DNA < 2000 国际单位 [IU] 的受试者,或筛选时正在接受核苷[酸]类似物治疗且HBV DNA 低于正常下限 [LLN] 的受试者有资格参与本研究)
13. 在研究药物灌注及随访期内怀孕或哺乳
14. 既往有明确的神经或精神障碍史,包括癫痫或痴呆
15. 其他严重的可能限制患者参加此研究的其他系统疾病(例如未控制的糖尿病、心脑血管疾病、严重的胃肠道疾病等
16. 其他任何研究者认为会导致受试者承受不必要风险,因此不适合参加本临床研究的状况
研究者信息
1、主要研究者信息
姓名:沈琳
学位:医学博士
职称:主任医师
单位名称:北京肿瘤医院
2、各参加机构信息
| 序号 | 机构名称 | (主要)研究者 | 国家 | 省(州)-城市 |
| 1 | 北京肿瘤医院 | 沈琳 | 中国 | 北京市-北京市 |
| 2 | 中山大学附属第一医院 | 蔡世荣 | 中国 | 广东省-广州市 |
| 3 | 河南省肿瘤医院 | 王居峰 | 中国 | 河南省-郑州市 |
| 4 | 中国医药大学附设医院 | 白礼源 | 中国台湾 | 台湾-台中 |
| 5 | 国立成功大学医学院附设医院 | 颜家瑞 | 中国台湾 | 台湾-台南 |
| 6 | 奇美医疗财团法人柳营奇美医院 | 林正耀 | 中国台湾 | 台湾-台南 |
| 7 | 高雄医学大学附设中和纪念医院 | 王照元 | 中国台湾 | 台湾-高雄 |
| 8 | The Catholic University of Korea, Seoul St. Mary’s Hospital | In-Ho Kim | 韩国 | NA-Seoul |
| 9 | Samsung Medical Center | Seung Tae Kim | 韩国 | NA-Seoul |
| 10 | Gangnam Severance Hospital, Yonsei University Health System | Hei-Cheul Jeung | 韩国 | NA-Seoul |
| 11 | Ajou University Hospital | Yong Won Choi | 韩国 | NA-Seoul |
| 12 | 北京大学第一医院 | 吴世凯 | 中国 | 北京市-北京市 |
| 13 | 吉林大学第一医院 | 李薇 | 中国 | 吉林省-吉林市 |




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城