主要目的: 评估 HLX10 联合化疗对比安慰剂联合化疗新辅助/辅助治疗胃癌的 临床疗效。
次要目的: 评估 HLX10 联合化疗对比安慰剂联合化疗新辅助/辅 助治疗胃癌的安全性和耐受性。 评估 PD-L1 表达与抗肿瘤治疗疗效的关系。
入选标准
1.自愿参加临床研究;完全了解、知情本研究并签署知情同意书 (Informed Consent Form,ICF);愿意遵循并有能力完成所有 试验程序。
2.性别不限,签署 ICF 时年龄≥ 18 岁且≤70 岁。
3.存在经过组织学确认的,未接受过治疗的胃癌或胃食管结合部 (GEJ)癌,且组织学检查证实主要为腺癌。胃食管结合部(GEJ) 癌仅允许 Siewert Ⅲ型、及不需要联合开胸手术的 Siewert Ⅱ 型受试者入组
4.首次用药前 4 周之内,由独立影像评估委员会(IRRC)判定为: ≥ T3 且淋巴结转移数目≥ 1 个,且无远处转移。
5.入组前由主治医生进行评估,以确定具有进行以治愈为目的的 R0 切除术的研究资格。
6.心脏功能良好,可进行以治愈为目的的切除术。如果有临床指 征,患有基础缺血性、瓣膜性心脏病或其他严重心脏病的患者应 由心脏病专家进行术前评估。
7.肿瘤标本检测结果为 PD-L1 阳性受试者(CPS ≥10)。受试者 必须提供入组时、以及本研究手术的(如果有)肿瘤组织以进行 PD-L1 表达水平测定。
8.既往使用过中药、中成药、免疫调节剂(如胸腺肽、香菇多糖、 白介素-12 等)结束距开始研究用药必须 ≥ 2 周。
9.首次用药前 7 天内的 ECOG PS 评分为 0 或 1。
10.预计生存期≥ 6 个月。
11.乙肝表面抗原(HBsAg)(-)并且乙肝核心抗体(HBcAb)(-)。 如果 HBsAg(+)或者 HBcAb(+),则乙肝病毒脱氧核糖核酸 (HBVDNA)必须< 1000 拷贝/mL 或<200 IU/mL 或<研究中心正 常值上限(ULN)方可入组
12.HCV 抗体(-)。
13.主要器官功能正常,即符合下列标准(在首次用药前 14 天内, 未接受过输血、白蛋白、重组人促血小板生成素或集落刺激因子 (CSF)治疗)
14.女性患者入组时为: 绝经(定义为至少 1 年内无月经,且除 绝经之外无其他确认原因)状态,或已行手术绝育(摘除卵巢和/ 或子宫),或具有生育能力的患者必须同时满足以下要求:1.首 次用药前 7 天内的血清妊娠试验结果必须为阴性;2.同意采用年 失败率< 1%的避孕措施或保持禁欲(避免异性性交)(从签署知 情同意书至试验药物末次给药后至少 120 天,化疗药物末次给药 后至少 6 个月)(年失败率< 1%的避孕方法包括双侧输卵管结扎、 男性绝育术、正确的使用可抑制排卵的激素避孕药、释放激素的 宫内避孕器和含铜的宫内避孕器),3.不得哺乳。
15.男性患者必须满足:同意禁欲(避免异性性交)或采取避孕措 施,避孕措施规定如下:伴侣为育龄期女性或伴侣已怀孕时,男 性患者必须在化疗治疗期间和化疗药物末次给药后至少 6 个月, 在试验药物末次给药后至少 120 天内保持禁欲或正确使用避孕套 避孕以防止药物暴露于胚胎。应参考临床研究持续时间、患者喜 好和日常生活方式评价性禁欲的可靠性。定期禁欲(例如,日历 日、排卵期、基础体温或后排卵期避孕方法)和体外射精是不合 格的避孕方法。
排除标准
1.5 年内或同时患有其它活动性恶性肿瘤。已治愈的局限性肿瘤, 如皮肤基底细胞癌、皮肤鳞癌、表浅膀胱癌、前列腺原位癌、宫 颈原位癌、乳腺原位癌等可以入组。
2. 准备进行或者既往接受过器官或骨髓移植的患者。
3. 首次用药前 6 个月内发生过心肌梗塞、控制不良的心律失常(包 括 QTc 间期男性≥450ms、女性≥ 470 ms)(QTc 间期以 Fridericia 公式计算)。
4. 存在 NYHA 标准Ⅲ~Ⅳ级心功能不全或心脏彩超检查:LVEF(左 室射血分数)< 50%。
5. 人类免疫缺陷病毒(HIV)感染。
6. 患有活动性肺结核病。
7. 既往和目前存在间质性肺炎、尘肺、放射性肺炎、药物相关肺 炎、肺功能严重受损等可能会干扰可疑的药物相关肺毒性的检测 和处理的患者。
8. 存在已知的活动性或可疑的自身免疫病。入组时处于该疾病稳 定状态者除外(不需要全身免疫抑制剂治疗)。
9. 首次用药前 28 天内接受过活疫苗的治疗;灭活病毒性疫苗治疗 季节性流感除外。
10. 首次用药前 14 天内或研究期间需要接受全身用皮质类固醇(> 10 mg/天泼尼松疗效剂量)或其他免疫抑制药物治疗的患者。但 以下情况允许入组:在没有活动性自身免疫疾病的情况下,允许 患者使用局部外用或吸入型类固醇、或剂量≤ 10mg/天泼尼松疗 效剂量的肾上腺激素替代治疗。
11. 首次用药前 14 天内,出现任何需要系统性给予抗感染治疗的 活动性感染;接受预防性抗生素治疗(如预防泌尿道感染或慢性 阻塞性肺疾病)除外。
12. 既往接受过其他针对免疫检查点的抗体/药物治疗,如 PD-1、 PD-L1、CTLA4 等治疗。
13. 正在接受其他临床研究治疗,或计划开始本研究治疗的时间距 离前一项临床研究治疗结束时间不足 14 天。
14. 已知对任何单克隆抗体或研究药物辅料有严重过敏史。
15. 已知有精神类药物滥用或吸毒史;已停止饮酒的患者可以入 组。
16. 存在可能增加参与研究和研究用药风险,或其他重度、急性和 慢性疾病,经研究者判断,不适合参加临床研究的患者。
主要研究者信息
姓名:季加孚,PhD
学位:医学博士
职称:主任医师
单位名称:北京肿瘤医院(北京大学 肿瘤医院)
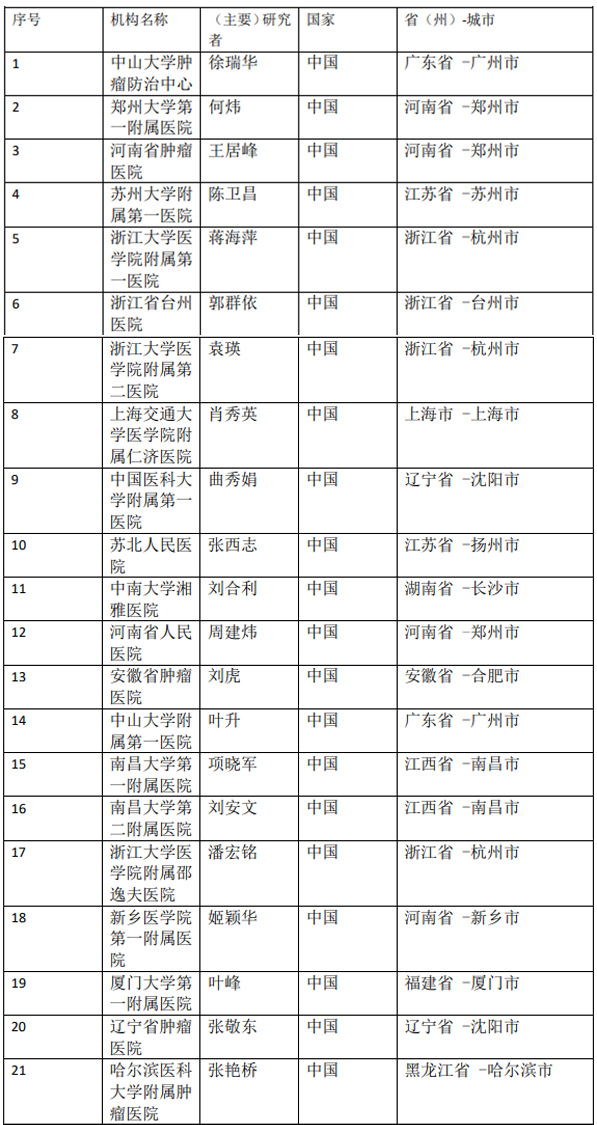
各参加机构信息




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城