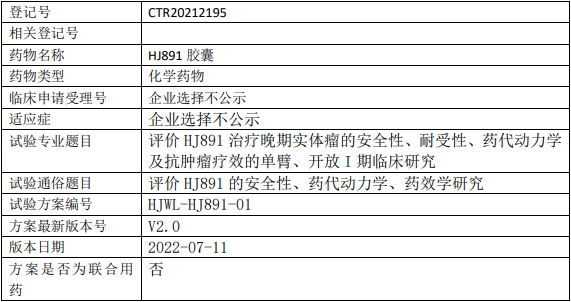
华健未来HJ891临床试验,评价HJ891胶囊治疗晚期实体瘤安全性、耐受性、药代动力学及抗肿瘤疗效的I期临床试验
试验目的
评价HJ891治疗晚期实体瘤的安全性、耐受性、药代动力学及抗肿瘤疗效的单臂、开放I期临床研究。
试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、受试者自愿参加本研究,且书面签署知情同意书;
2、年龄≥18岁,男女不限;
3、经组织病理学和/或细胞病理学确诊的,无标准治疗方案或标准治疗方案失败或不适合标准治疗方案的晚期实体瘤患者;
4、根据RECIST1.1标准,至少有一个可测量的靶病灶;
5、ECOG体力状况≤1分(见附录1);
6、预期生存时间≥3个月;
7、主要器官功能符合以下标准:
a)血常规:绝对中性粒细胞计数(ANC)≥1.5×109/L,血小板计数≥75×109/L,血红蛋白≥9g/dL;
b)血生化:AST≤2.5×ULN(如果有肝转移,≤5×ULN),ALT≤2.5×ULN(如果有肝转移,≤5×ULN),碱性磷酸酶≤2×ULN(如果有肝或骨转移,≤3×ULN),总胆红素≤1.5×ULN(如有吉尔伯特综合征的受试者≤2.0×ULN,间接胆红素水平表明肝外升高的受试者为3.0×ULN);血清肌酐≤1.5×ULN,或计算的肌酐清除率(Clcr)(如有)≥50mL/分钟(使用Cockcroft-Gault公式计算,见入选标准后注释);
c)凝血功能:凝血酶原时间(PT)或活化部分凝血活酶时间(APTT)<1.5×ULN,或国际标准化比率(INR)<1.5;当前正在接受抗凝药物治疗的受试者,INR须在其临床状态适用的建议范围内;
排除标准
1、受试者发生脑转移或脑膜转移(除外无症状脑转移或临床症状稳定的患者);
2、有无法控制的或重要的心脑血管疾病,包括:
a)首次给予研究药物前6个月内出现纽约心脏病协会(NYHA)II级以上充血性心力衰竭、不稳定型心绞痛、心肌梗塞,或在筛选时存在需要药物治疗的心律失常,左射血分数(LVEF)<50%;
b)有临床意义的QTc间期延长病史,或筛选期QTc间期女性>470ms、男性>450ms;
c)无法控制的高血压,为收缩压≥160mmHg或舒张压≥100mmHg;
3、胃肠道疾病导致不能口服药物,吸收不良综合征,需要静脉营养,不受控制的炎症性胃肠病(如克罗恩病,溃疡性结肠炎等);
4、有需要通过静脉注射抗生素来治疗的活动性感染;
5、首次给药前14天或5个半衰期内(以时间较短者为准)接受过分子靶向治疗、化疗、生物免疫治疗、维甲酸治疗、有抗肿瘤适应症的中药;在首次使用研究药物前14天或5个半衰期内(以时间较短者为准)接受过其它未上市的临床研究药物或治疗;
6、首次给药前14天内接受过治疗性或姑息性放射疗法;
7、在研究治疗首次给药前一周内或5个半衰期内(以时间较短者为准)无法停用CYP3A4强抑制剂或强诱导剂(见附录2);
8、入组前6个月内有深静脉血栓或肺栓塞;
9、不能控制的胸腔积液、心包积液或腹水;
10、既往抗肿瘤治疗相关的毒性未恢复至≤CTCAE1级,脱发除外;先前抗肿瘤治疗导致的不可逆转的(存在并稳定6个月以上)2级或3级毒性,如与异环磷酰胺有关的蛋白尿,如果排除标准中没有其他规定,经研究同意,可以入组;
11、入组前4周内接受过除诊断或活检外的重大的外科手术(如需要全身麻醉),或预期将在研究期间接受重大外科手术;
12、对试验药物及其辅料过敏的患者;
13、接受过器官移植的患者;
14、乙肝表面抗原(HBsAg)阳性且乙型肝炎病毒DNA拷贝数≥2000IU/mL的患者;丙型肝炎病毒(HCV)抗体阳性者,且HCVRNA阳性者;已知人类免疫缺陷病毒(HIV)感染;
15、妊娠期或哺乳期女性患者;
16、不同意在研究期间和研究结束后1个月内采用避孕措施(如宫内节育器[IUD],避孕药或避孕套)的育龄期女性患者;不同意在研究期间和研究期结束后1个月内必须采用避孕措施的有生殖能力的男性患者;
17、估计患者参加本临床研究的依从性不足;
18、研究者认为其他不适合参加本研究的情况。




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城