映恩生物DB1303临床试验,评估注射用DB-1303治疗晚期/转移性恶性实体瘤安全性、耐受性、药代动力学和初步抗肿瘤活性的I/IIa期临床试验
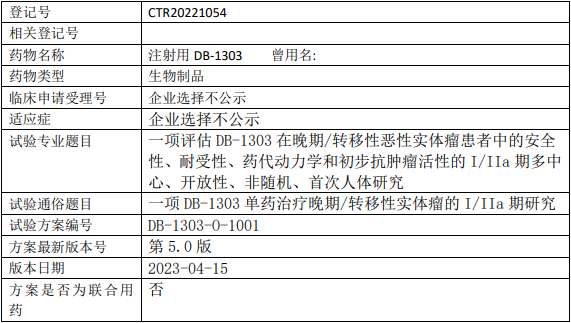
试验目的
剂量递增阶段
评价DB-1303的安全性和耐受性并确定其MTD或RP2D。
剂量扩展阶段
1、评估目标患者人群中DB-1303在MTD/RP2D下的安全性和耐受性;
2、使用客观缓解率(ORR)作为主要终点以评价DB-1303在MTD/RP2D下的初步有效性。
试验设计
试验分类:安全性和有效性
试验分期:其它 其他说明:I/IIa
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、年满18周岁的男性或女性患者。
2、研究者根据RECIST v1.1的标准进行评估,至少存在一个可测量病灶。
3、能够理解知情同意书中概述的研究程序和风险,并能够提供书面知情同意书。
4、ECOG PS评分:0-1分。
5、超声心动图(ECHO)或多门电路探测(MUGA)显示左心室射血分数(LVEF)≥50%。
6、具备适当的器官功能:
1)血小板计数≥100,000/mm3 (未输血);
2)血红蛋白(Hb)≥8.5 g/dL;
3)中性粒细胞绝对计数(ANC)≥1500/mm3(无粒细胞集落刺激因子支持);
4)肌酐清除率≥50 mL/min(改良Cockcroft-Gault公式);
5)AST/ALT≤3×ULN(如有肝转移,则≤5×ULN);
6)总胆红素≤1.5×ULN;
7)凝血酶原时间(PT)和活化部分凝血活酶时间(APTT)≤1.5×ULN。
7、经过适当的洗脱期:
1)化疗(包括抗体药物治疗)≥3周(5-氟尿嘧啶类药物、亚叶酸类药物和/或每周紫杉醇治疗≥2周。亚硝基脲或丝裂霉素C治疗≥ 6周);
2)免疫治疗≥4周;
3)激素治疗≥2周,用于治疗前列腺癌的促性腺激素释放激素(GnRH)激动剂或拮抗剂或者口服避孕药除外;
4)具有抗肿瘤活性的中药≥2周;
5)大手术≥4周,不包括可在第1次给药前14天内恢复且研究者确认已恢复的操作或手术,例如肿瘤活检、穿刺、姑息性手术、直肠/胃造口术等;
6)放射治疗≥4周(如果采用非腹部姑息性立体定向放射治疗,则≥2周);7)自体移植≥3个月。
8、愿意提供既存HER2状态诊断结果或切除的肿瘤样本或进行新鲜肿瘤活检用于HER2检测。
9、预期寿命≥3个月。
排除标准
1、有症状性CHF(纽约心脏病协会[NYHA] II-IV级)或需要治疗的严重心律失常病史。
2、第一天前6个月内有心肌梗死或不稳定型心绞痛病史。
3、根据三次12导联心电图(ECG)检查结果,男性平均QTcF延长至>450毫秒(ms),女性平均QTcF延长至>470 ms。
4、有具有临床意义的肺部疾病病史(例如,间质性肺炎、非感染性肺炎、肺纤维化和重度放射性肺炎)或在筛选时通过影像学检查怀疑患有此类疾病。
5、存在未受控制的感染,需要静脉注射(IV)抗生素、抗病毒药或抗真菌药。
6、患有人类免疫缺陷病毒(HIV)感染伴获得性免疫缺陷综合征(AIDS)定义性疾病者;活动性病毒性(任何病因)肝炎患者;。
7、妊娠期或哺乳期女性。
8、男性和女性受试者不愿意在研究期间以及研究药物末次给药后至少7个月内采取充分避孕方法(例如双重屏障法或宫内避孕)。
9、有临床活动性脑转移或者需要类固醇或抗惊厥药治疗以控制相关症状者。
10、既往抗癌治疗的毒性未消退至≤1级(NCI-CTCAE第5.0版)或基线水平。
11、存在合并疾病且研究者认为会增加毒性风险。
12、已知对原料药或制剂中的非活性成分过敏。
13、研究者认为有其他原因导致其不适合参加本研究的患者。




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城