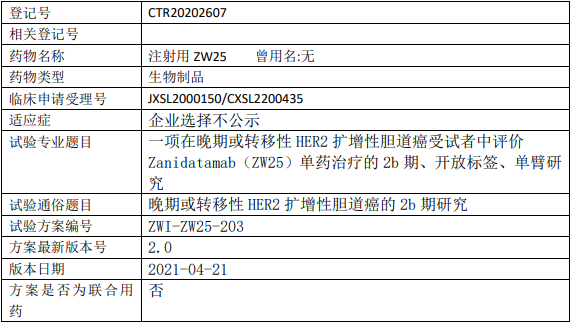
百济神州Zanidatamab临床试验,评价Zanidatamab(ZW25)单药治疗晚期或转移性HER2扩增性胆道癌的II期临床试验
试验目的
主要目的
评价Zanidatamab单药治疗晚期或转移性HER2扩增性胆道癌(BTC)受试者的抗肿瘤活性。
次要目的
1、进一步评价Zanidatamab单药治疗晚期或转移性HER2扩增性BTC受试者的抗肿瘤活性;
2、评价Zanidatamab单药治疗晚期或转移性HER2扩增性BTC受试者的安全性和耐受性;
3、评价Zanidatamab的药代动力学(PK);评价Zanidatamab的免疫原性。
探索性目的
1、按BTC解剖学亚型评价Zanidatamab单药治疗的抗肿瘤活性;
2、评价潜在血清和肿瘤生物标志物的效用;
3、评价Zanidatamab治疗对生活质量(QOL)的影响;
4、评价Zanidatamab治疗对疾病相关疼痛和用于控制疼痛的阿片类药物使用情况的影响。
试验设计
试验分类:有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至65岁(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、经组织学或细胞学证实为胆道癌(BTC),包括肝内胆管癌(ICC)、肝外胆管癌(ECC)或胆囊癌(GBC)。
2、局部晚期或转移性BTC,且不适合采用根治性切除、移植或消融治疗等治疗手段。
3、既往至少接受过1种用于晚期疾病的含吉西他滨的全身性化疗方案,且经最近一次方案治疗后发生疾病进展或出现对该治疗不耐受;对于在既往辅助或新辅助治疗中接受过吉西他滨的受试者,如果在初步手术切除或含吉西他滨的辅助治疗完成(以较晚者为准)后<6个月内出现进展,则视为接受过1种用于晚期疾病的既往治疗。
4、根据RECIST 1.1评估,受试者必须至少有1处可测量的靶病灶;既往接受过局部治疗(栓塞、化疗栓塞、射频消融或放射疗法)的受试者可以入组,前提是该次治疗不涉及这一可测量病灶,或虽在治疗区域内,但自治疗后评估以来尺寸增加≥ 20%
5、在中心实验室采用中心原位杂交(ISH)测定法检测受试者提供的新活检或存档组织的HER2扩增情况, 结果必须呈阳性。
排除标准
1、在首次给药前3周内接受过全身性抗癌治疗;在首次给药前2周内接受过放射治疗
2、在首次给药前4周内进行过大手术。
3、治疗后不稳定的严重急性感染或慢性感染。
4、存在未经治疗的中枢神经系统(CNS)转移、有症状的CNS转移或在研究药物治疗前4周内接受过CNS转移放射治疗;已治疗且进入稳定状态的脑转移可以入组(定义为受试者在筛选前停用类固醇和抗惊厥药至少已达4周,并且神经系统症状稳定,无影像学进展证据)。
5、已知患有软脑膜疾病(LMD);如果基线 MRI 影像学报告有LMD,但研究者在临床上没有怀疑,受试者必须没有LMD的神经症状。




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城