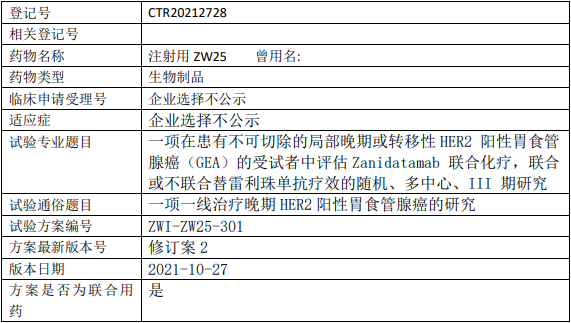
百济神州Zanidatamab临床试验,评估Zanidatamab(ZW25)联合化疗,联合或不联合替雷利珠单抗治疗不可切除的局部晚期或转移性HER2阳性胃食管腺癌的III期临床试验
试验目的
主要目的
在不可切除的局部晚期、复发或转移性HER2阳性GEA受试者中比较Zanidatamab联合化疗,联合或不联合替雷利珠单抗的疗效与曲妥珠单抗联合化疗的疗效。
次要目的
1、进一步比较Zanidatamab 联合化疗,联合或不联合替雷利珠单抗与曲妥珠单抗联合化疗的疗效;
2、评价Zanidatamab 联合化疗,联合或不联合替雷利珠单抗的安全性和耐受性;
3、评价Zanidatamab 联合化疗,联合或不联合替雷利珠单抗对健康相关生活质量(HRQoL)的影响;
4、评价Zanidatamab 联合化疗,联合或不联合替雷利珠单抗的药代动力学(PK);
5、评价替雷利珠单抗联合化疗和Zanidatamab 的PK;
6、评价Zanidatamab 联合化疗,联合或不联合替雷利珠单抗的免疫原性;
7、评价替雷利珠单抗联合化疗和Zanidatamab 的免疫原性。
试验设计
试验分类:安全性和有效性
试验分期:III期
设计类型:平行分组
随机化:随机化
盲法:开放
试验范围:国际多中心试验
受试者信息
年龄:18岁(最小年龄)至无上限(最大年龄)
性别:男+女
健康受试者:无
出入排标准
入选标准
1、经组织学确认有不可切除的局部晚期、复发性或转移性HER2 阳性胃食管腺癌,定义为经中心实验室评估HER2 表达水平为IHC 3+或IHC 2+且ISH 阳性。
2、美国东部肿瘤协作组(ECOG)体能状态评分为0或1。
3、充足的血液学和器官功能。
4、左心室射血分数(LVEF)≥50%。
5、女性受试者血清/血浆或尿液β人绒毛膜促性腺激素(β-hCG)妊娠试验结果必须为阴性。
6、同意采取高效的避孕措施。
7、受试者或受试者的法定代表必须提供书面知情同意书。
排除标准
1、既往接受过HER2靶向药物治疗。
2、既往接受过抗PD-1、抗PD-L1、抗PD-L2治疗。
3、既往接受过针对不可切除的局部晚期、复发性或转移性GEA的全身性抗肿瘤治疗。
4、需皮质类固醇或其他免疫抑制剂全身治疗的病症。
5、对研究药物中任何活性成分和/或药物制剂成分中所列任何辅料有超敏反应史或存在禁忌症。
6、在随机化前28天内接受过大手术。
7、存在未经治疗的中枢神经系统转移或已知软脑膜疾病。
8、既往或并发浸润性恶性肿瘤。
9、重度慢性或活动性感染以及控制不良的肝肾疾病。
10、已知患有活动性肝炎,包括:急性或慢性乙型肝炎和丙型肝炎感染,除外一些控制良好的情况。
11、有人类免疫缺陷病毒(HIV)感染史。
12、有临床显著性心脏病或、间质性肺病、症状性肺栓塞或近期出现的脑血管意外。
13、既往抗肿瘤治疗导致的持续存在的临床显著性毒性(2级或更高级别)。
14、既往曾进行异基因干细胞移植或器官移植。
15、患有活动性自身免疫性疾病。
16、哺乳期或妊娠期女性,以及正在备孕的女性和男性。




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城