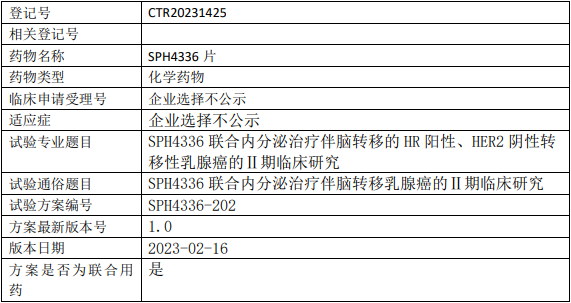
上海医药SPH4336临床试验,SPH4336片联合内分泌治疗伴脑转移的HR阳性、HER2阴性转移性乳腺癌的II期临床试验
试验目的
评价SPH4336联合内分泌治疗伴脑转移的HR阳性、HER2阴性转移性乳腺癌患者的安全性和有效性。
试验设计
试验分类:安全性和有效性
试验分期:II期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
受试者信息
年龄:18岁(最小年龄)至75岁(最大年龄)
性别:女
健康受试者:无
出入排标准
入选标准
1、自愿参加本研究,完全了解本研究并自愿签署知情同意书;
2、ECOG体力状况0或1分;
3、预期生存期≥3个月;
4、不能进行根治性的手术/其他局部治疗的HR阳性、HER2阴性局部晚期或转移性乳腺癌患者;
5、受试者至少有一个可测量脑转移病灶;
6、绝经后或绝经前/围绝经期女性患者,绝经前或围绝经期妇女在研究期间均需同意接受戈舍瑞林治疗。
7、实验室检查结果满足一定的器官功能要求;
8、受试者同意采用有效的避孕措施避孕。
排除标准
1、炎性乳腺癌;
2、研究者判断不适合内分泌治疗的患者;
3、开始研究治疗前有其他恶性肿瘤病史;
4、签署知情同意书时仍在接受有抗肿瘤适应症的中成药治疗;
5、开始研究治疗前接受过手术,且未从手术的不良反应中恢复;
6、开始研究治疗前参加了临床试验且接受了其他试验药物治疗者;
7、处于妊娠期或哺乳期的女性;
8、开始研究治疗前发生过心肌梗死、不稳定型心绞痛、严重的心律失常、症状性充血性心力衰竭;纽约心脏病学会心功能不全分级≥II级;QTc间期均值≥470ms;心脏左室射血分数≤50%;
9、开始研究治疗前发生过缺血性脑卒中或严重的血栓栓塞疾病;
10、乙肝病毒表面抗原阳性且HBV DNA>2000 IU/ml或10(4)拷贝数/mL者;HCV抗体阳性且HCV RNA阳性者;或已知HIV感染者;
11、严重过敏性疾病史、严重药物过敏史或已知对本试验用药任何成分过敏;
12、开始研究治疗前存在影响药物服用或影响胃肠道吸收功能的疾病;
13、开始研究治疗前存在不可控制的感染;
14、已知患者有药物滥用、酗酒或吸毒史,既往有明确的神经或精神障碍史;
15、患有其他疾病,研究者认为接受本研究治疗风险大于获益,或研究者认为有任何不宜入选本研究的其他原因。




























 首页
首页 咨询
咨询 方舟新药
方舟新药 营养商城
营养商城