时间:2021-12-29 11:36 编辑:全球肿瘤医生网
肝癌细胞免疫治疗,CAR-T细胞疗法治疗肝癌让晚期肝癌患者还有机会抓住一线生机
2020年的统计数据显示,接近一半的新发肝癌患者来自我国。而超高发病率背后还站着超高的死亡率,我国2020年因肝癌死亡的患者数量,超过39万。
从治疗的角度来说,我国肝癌外科治疗的水平绝对是位居世界前列的。许多外国医生做不到的高难度、高危险手术,在经验丰富的中国医生手中都能成为现实。
但我国的肝癌内科治疗,发展比外科还是差了一些。这不难理解,我国在各类靶向药物、免疫药物、细胞免疫疗法的研究方面起步较晚。尽管现在追赶的步伐很迅猛,但想要弥补与发达国家这么多年的差距,还需要一些时间。
细胞免疫疗法,尤其是其中的CAR-T细胞疗法,已经成为了目前癌症治疗的一大热门发展方向。与以VEGFR抑制剂及多靶点抑制剂为主的肝癌靶向治疗方案相比,肝癌的细胞免疫治疗靶点更加丰富,包括对这类癌症有独特意义的GPC3等靶点在内,肝癌的细胞免疫治疗很有希望超越靶向治疗,为患者创造更好的生存良机。
这一次,我们为大家分享两位接受了细胞免疫治疗临床试验的患者的病例。两位患者都是多灶性肝细胞癌,其中一位病灶直径最初在3厘米以上,治疗后明显缩小;另一位病史长达3.7年,接受治疗后,3个大病灶消失了2个!
1、3厘米病灶,缩小到1厘米
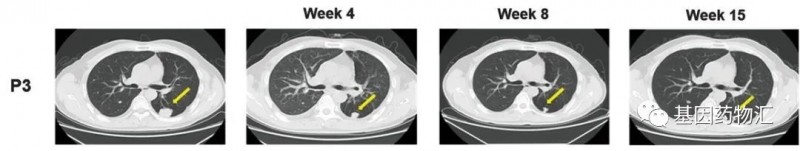
编号为P3的患者是一位50岁的男性,多灶性肝细胞癌病史超过2.2年,GPC3 IHC染色评分3+。
从接受治疗4周开始,这位患者的病灶体积就开始逐渐缩小,至治疗15周时,图中黄色箭头标注的病灶,已经从31.0 27.8 mm 逐渐缩小到了 12.2 9.5 mm!
CAR-GPC3 T细胞为这位患者带来了长达111天的无进展生存,以及615天的生存期!整个治疗过程中,患者经历的不良反应包括比较轻度的细胞因子释放综合征,以及一些发热。
(患者P3)
2、三年多的病史,4周病灶消失
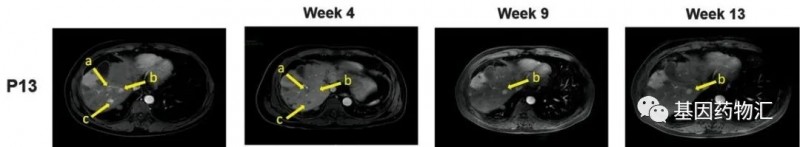
编号为P13的患者是一位52岁的男性,多灶性肝细胞癌的病史更是长达3.7年。该患者曾经接受过5次经导管动脉化疗栓塞手术和11次热消融治疗。检测时,患者的GPC3 IHC染色评分同样为3+。
MRI扫描共锁定了患者的3个病灶(黄色箭头标注的a、b、c病灶),从治疗4周后,a和c病灶完全消失,b病灶从14.2 13.4 mm略微缩小至13.9 13.0 mm。
治疗的过程中,患者经历了2级的细胞因子释放综合症,但已经通过对应的治疗从中康复。截至病例发布时,患者仍然保持生存,CAR-GPC3 T细胞疗法已经为这位患者带来了99天的持续缓解,以及超过385天的生存期,这个数据还在增涨!
(患者P13)
两项来自中国的肝癌CAR-T技术,成果喜人
在本年度(2021年)的ASCO年会上,两项分别来自不同中国公司的CAR-T细胞技术,在肝癌这一领域展现出了卓绝的潜力。
曾多次为癌症患者带来奇迹的CAR-T细胞免疫治疗方案,携手肝癌最有希望的新靶标之一GPC3,似乎有望在肝癌领域再创佳绩!
01、新一代CAR-T疗法:疾病控制率最高71.4%
其中一项Ⅰ期临床试验,根据其研究者的介绍,使用的是一类经过改进的第二代CAR-T治疗方案,名为G3-CAR-ori2,由上海原能细胞研发。
与传统的第一代CAR-T方案相比,第二代方案能够产生更多具有记忆能力、增值能力以及杀伤能力的T细胞,能够为患者提供更长期、更好的疗效。
公开的报告中包含了两个中心提交的数据,共统计了7例GPC3阳性的晚期患者的治疗结果,其中3例患者达到临床缓解,2例患者疾病控制稳定,2例患者疾病进展;整体缓解率为42.9%,疾病控制率71.4%。
在达到了临床缓解的患者中,已经有一例患者持续了4个月。
02、新一代CAR-T疗法:疾病控制率50%
另一项Ⅰ期临床试验使用的是被称为4G-CAR-GPC3 T细胞的制剂,由我国科济生物医药研发。这类制剂同样属于优化的第二代CAR-T治疗方案,具有更加强大的潜力。
截至2021年1月30日,共有6例患者接受了治疗。经过1~2个周期的治疗后,这部分患者中16.7%达到了临床缓解,50%的患者疾病控制稳定。
当然,中国并不是这场大会上唯一一个推出了CAR-GPC3 T细胞治疗方案的国家。来自美国的细胞免疫治疗研发上Adicet Bio公司同样推出了他们自主研发的、用于治疗GPC3阳性肝癌患者的GPC3-CAR V1 T细胞疗法,不过在会上这项研究暂未公开结果,我们会继续保持关注。
肝癌治疗的希望之星GPC3
GPC3是一种基因的名称,由它指导合成的蛋白质名为Glypican-3。这条基因的所在位置有点特殊,位于人类X染色体上。
通常情况下,GPC3基因和它对应的Glypican-3蛋白质会在分裂以及旺盛生长的细胞中发挥作用。但当GPC3基因发生突变,Glypican-3蛋白结构异常、或者在本不该表达这一蛋白质的细胞中旺盛表达的时候,细胞的生长就会变得异常旺盛且毫无节制,最终发生癌变。
GPC3驱动的肝癌,大约占所有肝癌的70%(在鳞状非小细胞肺癌中也占到了63%)。对于一种治疗性靶标来说,这样高的比例几乎意味着,针对这一靶标的药物或疗法一旦成功上市,必定会彻底颠覆原有的标准治疗格局。
目前美国的多家药企已经开启了多项针对GPC3的药物研究或试验计划,例如人类纳米抗体HN3、人源化单克隆抗体HS20、ADC药物YP7以及GC33等等。这些药物的研发进展各不相同,结果也有一些参差,不过整体来说,蓬勃的发展验证了GPC3这一靶标的潜力。
以CAR-T细胞疗法为代表的细胞免疫治疗是癌症治疗的一个全新的研究领域,已经在各类血液系统肿瘤的治疗中取得了非常出色的成就。在实体瘤的治疗领域,细胞免疫治疗发展迅速,尽管尚未有药物获得上市批准,但已经在临床试验中展现出了不错的潜力。
在肝癌的细胞治疗领域,GPC3是目前研究最多的靶标之一。在我国,除了本次亮相ASCO的两款CAR-T细胞制剂以外,还有许多同靶点的细胞制剂,在前期研究中公开了非常出色的结果。
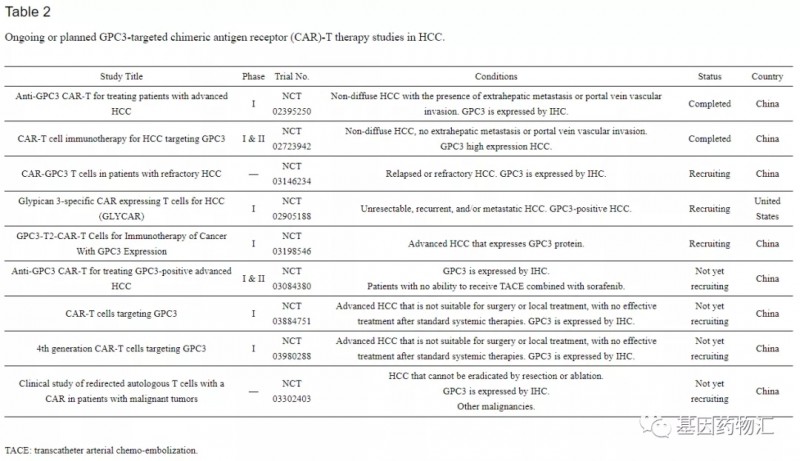
已经进入临床试验的CAR-GPC3 T细胞项目中,绝大部分来自中国。
03、新一代CAR-T疗法:42%的患者生存超过1年
综合两项Ⅰ期临床试验的结果,研究者共评估了13例患者,接受一款同样由科济生物研发的CAR-GPC3 T细胞疗法的治疗结局。
这些患者都属于晚期肝癌患者,在接受治疗前的2年内至少复发过两次,尝试过各类标准治疗方案无效。而治疗的结果显示,这些患者的6个月生存率为50.3%,1年生存率为42.0%,3年生存率仍然有10.5%!
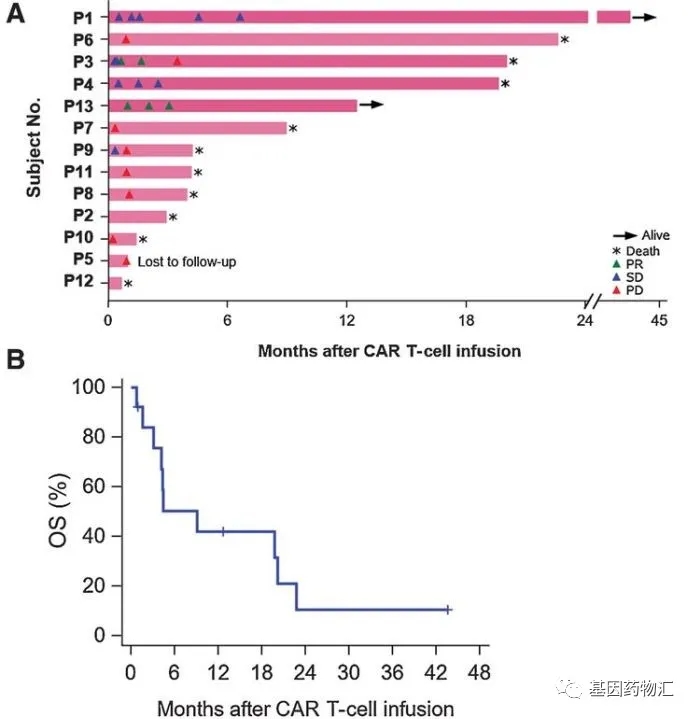
目前,多项CAR-GPC3 T细胞项目临床试验正在招募患者。对于广大肝癌患者来说,这绝对是一个扭转生存期的希望。有需求的患者可以联系基因药物汇-临床新药招募中心了解试验详情,或进行申请。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。