时间:2022-04-06 11:55 编辑:全球肿瘤医生网
阿基仑赛注射液(Yescarta、FKC876、Axi-Cel、益基利仑赛)获FDA批准二线治疗,中国上市的CAR-T疗法治疗价格、费用、多少钱
阿基仑赛注射液获批二线治疗
2022年4月1日,FDA宣布批准Axicabtagene Ciloleucel(Yescarta,Axi-Cel)的新二线治疗适应症,用于一线化学免疫治疗难治或首次治疗后12个月内复发的大B细胞淋巴瘤成年患者。需要注意的是,这种疗法不适用于原发性中枢神经系统淋巴瘤患者。
该批准基于ZUMA-7试验的结果。受试的患者尚未开始接受复发或难治性疾病的治疗,是自体造血干细胞移植(HSCT)的潜在候选者。
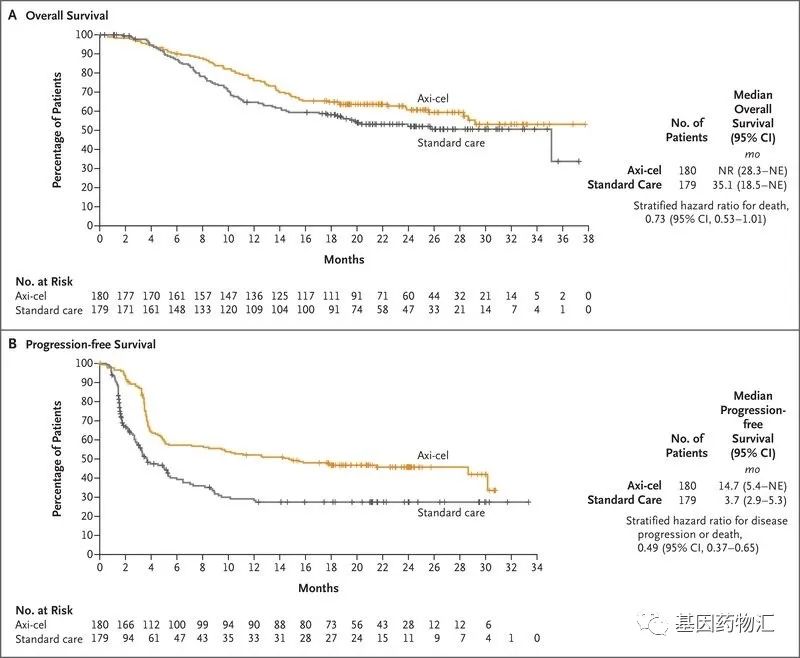
共359例患者参与了临床试验。这些患者被分为试验组与对照组,试验组接受氟达拉滨+环磷酰胺淋巴耗竭化疗(清淋)后单次输注Yescarta治疗,对照组会根据医生对病情的评估,选择2或3个周期的清髓化疗后大剂量治疗及自体造血干细胞移植等。
试验结果显示,接受Yescarta治疗的患者,18个月无事件生存率为41.5%,而标准治疗的对照组患者仅为17.0%;Yescarta治疗患者的中位无事件生存期为8.3个月,对照组患者仅为2.0个月。
从缓解率方面来说,Yescarta治疗的患者整体缓解率为83%,包括了65%的完全缓解和18%的部分缓解;对照组患者仅为50%,包括了32%的完全缓解和18%的部分缓解。
从生存期多方面来说,Yescarta治疗的患者中位无进展生存期为14.7个月,中位总生存期已经超过了36个月,目前仍有超过50%的患者生存;而对照组患者的中位无进展生存期为3.7个月,中位总生存期为35.1个月。
图片来源为已经公开发布的论文
在不良反应方面,Yescarta治疗的患者3级及以上严重不良事件的发生率为91%,对照组患者为83%。
整体来说,与现有的、包括自体造血干细胞移植在内的标准治疗相比,Yescarta非常显著地改善了患者的无事件生存期,并且能够使更多的患者从治疗当中获益。
关于Yescarta
Yescarta是首款在中国上市的CAR-T细胞产品,为CAR-CD19-T细胞疗法,在国内使用的名称为益基利仑赛注射液。
益基利仑赛注射液
(阿基仑赛;Yescarta,Axicabtagene Ciloleucel,Axi-Cel;FKC876)
状态:批准上市(NMPA/FDA)
时间:2021年6月23日(NMPA),2021年3月5日(FDA)
价格:120万人民币/针(国内售价)
简介:Yescarta是一款CAR-CD19 T细胞疗法,曾经在滤泡性淋巴瘤适应症上获得FDA授予的突破性疗法指定和优先审查资格。此前,FDA曾经批准过Yescarta的大B细胞淋巴瘤适应症。此次获批后,Yescarta成为了滤泡性淋巴瘤的首款CAR-T细胞免疫疗法。同时,Yescarta也是首款在中国上市的CAR-T细胞产品。
适应症:大B细胞淋巴瘤(接受过二线或以上标准治疗后复发或难治性大B细胞淋巴瘤成年患者,包括弥漫性大B细胞淋巴瘤非特指型、原发性纵隔B细胞癌淋巴瘤、高级别B细胞淋巴瘤和滤泡淋巴瘤转化的弥漫性大B细胞淋巴瘤);滤泡性淋巴瘤(复发或难治性滤泡性淋巴瘤,成年患者,经过两次或以上全身治疗)
相关临床试验及数据:
【ZUMA-5试验】整体缓解率达到了91%,完全缓解率高达60%;中位随访14.5个月时尚未达到中位缓解持续时间,74%的患者缓解持续时间超过18个月。
在目前已经获批上市(仅考虑FDA或NMPA批准)的CAR-T疗法当中,CD19靶点的产品是最多的。
从2021年至今,我国上市的3款CAR-T细胞产品当中,就有两款(益基利仑赛注射液,瑞基奥仑赛注射液)为CAR-CD19-T细胞产品,适应症均为大B细胞淋巴瘤,且均为接受过二线及以上治疗的疾病。此次二线治疗适应症的获批,代表着我国的大B细胞淋巴瘤患者,也有希望在比较短的时间内,迎来一款新的二线治疗方案。
另外两款中国上市的CAR-T疗法
另外两款已经在国内获批的CAR-T细胞疗法的简介,我们也列在了下方。
瑞基奥仑赛注射液
(Relma-cel,JWCAR029)
状态:批准上市(NMPA)
时间:2021年9月3日
价格:129万人民币/针
简介:第二款在中国上市的CAR-T细胞产品,同时也是首款正式获批上市的国产CAR-CD19-T疗法,由上海药明巨诺研发。
适应症:大B细胞淋巴瘤(经过二线或以上系统性治疗后复发或难治性大B细胞淋巴瘤成年患者)
相关临床试验及数据:
整体缓解率为60.3%。
西达基奥仑赛注射液
(LCAR-B38M,JNJ-4528,Cilta-cel,Carvykti)
状态:批准上市(NMPA)
时间:2022年2月28日
价格:46.5万美元/针(约合人民币294万元)
简介:第三款在中国上市的CAR-T细胞产品,是一款由杨森公司(Janssen)和传奇生物合作开发的CAR-BCMA-T疗法。
适应症:多发性骨髓瘤(复发/难治性多发性骨髓瘤成人患者)
相关临床试验及数据:
【CARTITUDE-1试验】整体缓解率98%,其中83%的患者达到严格的完全缓解;患者18个月无进展生存率66%,2年无进展生存率61%;18个月总生存率81%,2年总生存率74%。
救命疗法却是天价?临床试验也能救命
目前在中国上市的三款CAR-T产品,一款一针120万、一款一针129万、一款一针46.5万美元(约合人民币294万),对于绝大多数患者来说,都是一个比较难承受的价位。
CAR-T疗法的花费显然是不菲的,但同时,我国又是CAR-T细胞疗法研究及临床试验项目最多的国家,大量国内中心的试验项目正在招募中国患者。对于符合适应症需求的患者来说,这是一个提前享受新药治疗且避免巨额开销的好渠道。
希望尝试CAR-T疗法以及其它免疫细胞疗法的患者,可以联系基因药物汇-临床新药招募中心进行申请。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。