时间:2022-04-24 15:13 编辑:全球肿瘤医生网
国内首款FGFR抑制剂达伯坦(Pemigatinib、佩米替尼)获批上市,多款FGFR基因突变靶向药横扫16大癌种
达伯坦获批上市
近些年来,新药的研发和基因检测技术的双重发展的加持下,越来越多的靶点被医学研究者们发掘并研发出有效的药物应用于临床,给众多身陷囹圄的癌症患者带来了长生存的希望。
2022年4月6日,信达生物宣布其引进的佩米替尼片(Pemigatinib,商品名:达伯坦)在中国获批上市,用于既往至少接受过一种系统性治疗,且经检测确认存在有FGFR2融合或重排的晚期、转移性或不可手术切除的胆管癌成人患者的治疗。

截图源自NMPA官网这则振奋人心的消息意味着国内首款获批上市的FGFR抑制剂终于来了,它的上市填补了国内胆管癌靶向治疗的空白,也意味着唯化疗时代的终结。
与此同时,FGFR靶向药也逐渐进入到大众的视野中,对于FGFR靶点,各位癌友们可能比较陌生。但是作为目前不限癌种疗法的聚焦的热门靶点之一,FGFR(成纤维细胞生长因子受体)上市的适应症主要集中在胆管癌和尿路上皮癌上,除此之外,该靶点覆盖了超过16大癌种,主要包括肺鳞癌、肝癌、胃癌、乳腺癌等多种实体瘤。
新兴抗癌靶点:FGFR,你了解吗
FGFR基因家族,一共包括FGFR1、FGFR2、FGFR3、FGFR4这四种亚型及一些异构分子,常见的突变类型包括基因扩增/融合/缺失突变,详见下表。

肿瘤中常见的FGFR基因畸变
FGFR基因变异通常在肺癌、肝癌、肝内胆管癌、乳腺癌、胃癌、子宫癌及尿路上皮癌等实体瘤中广泛存在,并且不同癌种的FGFR突变类型及频率也存在差异。
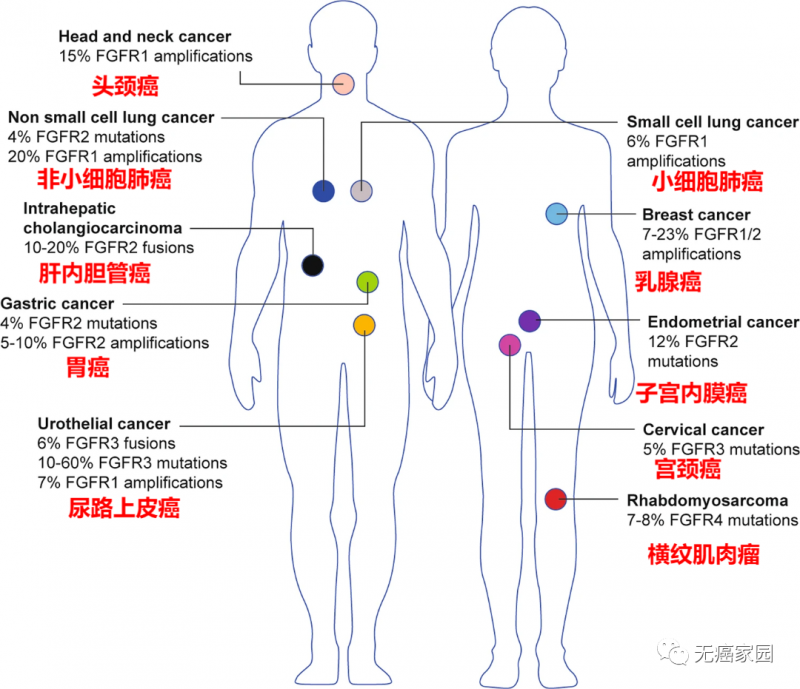
具有FGFR改变的癌症类型
在2016年发表的一项4853例的各癌种下一代测序技术(NGS)检测结果发现,可观察到360种FGFR异常,发生频率为7.1%,尤其在尿路上皮癌(32%)、乳腺癌(18%)、子宫内膜癌(13%)、鳞状细胞肺癌(13%)、卵巢癌(9%)、原发灶未知癌(8%)多见。
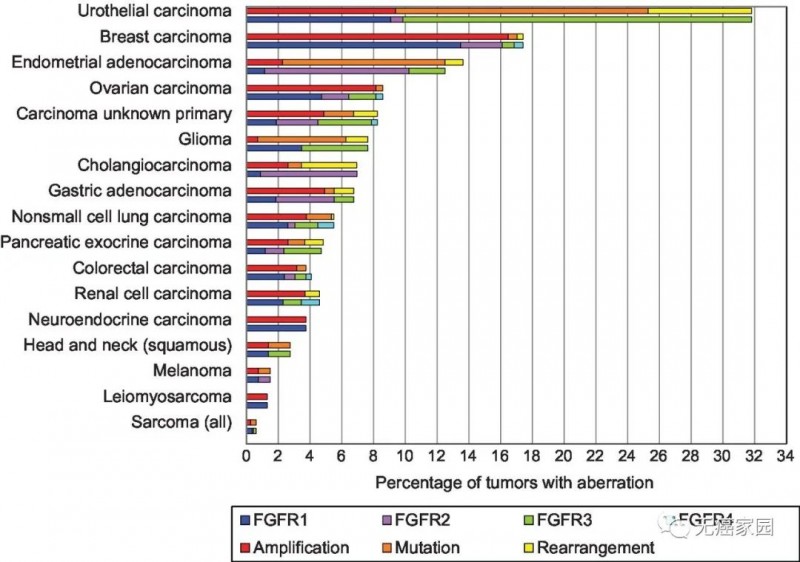
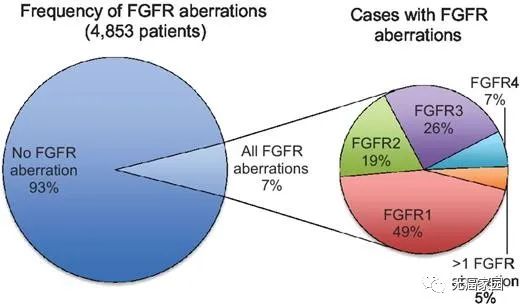
其中66%为基因扩增、26%为基因突变,8%为染色体重排。FGFR1变异率远高于其它3种亚型,占49%,FGFR2变异率为19%,FGFR3和FGFR4分别占26%和7%,并且约有5%患者存在1种以上FGFR亚型变异。
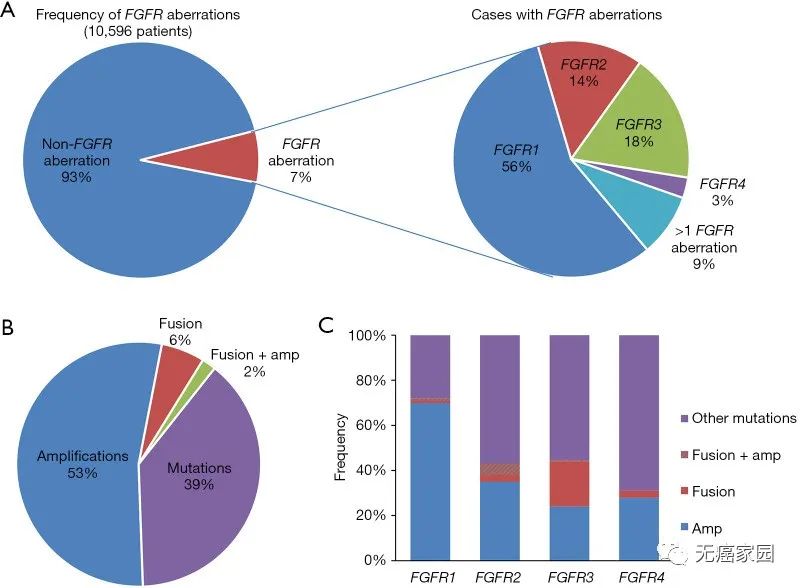
在一项涉及16种癌症类型、针对10,582例中国癌症患者的基因组分析研究中,745例患者中发现了FGFR异常,相当于7.0%的患病率,大多数畸变发生在FGFR1 (56.8%),其次是FGFR3 (17.7%)、FGFR2 (14.4%) 和FGFR4 (2.8%)。发生两种或以上变异形式的患者为8.5%左右。对于中国人群而言,发生FGFR变异相对校多的癌种包括:结直肠癌(31%)、胃癌(16.8%)、乳腺癌(14.3%)和食道癌(12.7%)等。
FGFR1~4基因畸变常见的癌种
●FGFR1
△FGFR1 基因扩增已证实在不同的肿瘤类型中被发现,包括鳞状非小细胞(17%)和小细胞肺癌(6%) 、雌激素受体阳性的乳腺癌(10%) 、卵巢癌(5%) 和膀胱癌(2%) 。
△据报道,FGFR1 基因融合在肺鳞状细胞癌、乳腺癌、胶质母细胞瘤和脑肿瘤中均被发现。
●FGFR2
△FGFR2基因的扩增在三阴性乳腺癌(4%)和不良预后的胃癌(7%~9%)中都有报道。FGFR2基因突变在子宫内膜癌(12%)、肺癌(4%~5%)、胃癌(10%)和尿路上皮癌(2%)中被发现。
△FGFR2融合蛋白存在于肺腺癌、鳞状细胞癌、甲状腺癌、前列腺癌和胆管癌中。
●FGFR3
△FGFR3扩增见于尿路上皮癌、乳腺癌、卵巢癌、胆囊癌和腺样囊性癌。
△FGFR3基因突变存在于70%的非肌肉浸润性肿瘤和20%的浸润性膀胱肿瘤、宫颈癌、多发性骨髓瘤和口腔鳞状细胞癌中。
●FGFR4
△FGFR4激酶域激活突变在横纹肌肉瘤(7%~8%)、恶性肺腺癌、恶性胶质瘤、乳腺癌等肿瘤中均有发现。
△39%的食管鳞状细胞癌患者和82%的恶性外周神经鞘膜瘤患者存在FGFR4异常过表达,此外过表达的癌种还包括卵巢癌、胃癌、胰腺癌、结肠癌等。
为了方便癌友们更加直观了解关于FGFR抑制剂的临床试验,小编特地整理无癌家园目前正在招募中的临床试验项目,其中涵盖了胆管癌、肝癌及胃癌等实体瘤癌种。
想要评估病情是否能够接受新药临床试验,可将病理报告、治疗经历及出院小结等提交至无癌家园医学部进行初步评估!

多款上市及在研的热门FGFR抑制剂轮番登场
接下来,无癌家园小编再给大家分享下多款上市及在研的热门FGFR抑制剂药物,以供各位参考。
三款已上市的FGFR靶向药物
截至目前,全球有三种获批准泛FGFR抑制剂:分别是Incyte公司的Pemazyre(即Pemigatinib,佩米替尼)、强生的Balversa(厄达替尼)及QED Therapeutics的Infigratinib(英菲格拉替尼)。
首款胆管癌靶向药:Pemigatinib
有研究表明,在胆管癌中约有40%的患者存在潜在的可靶向性的基因突变,具有靶向治疗的可能。胆管癌患者主要突变基因有KRAS、BRAF、FGFR2、IDH1/2等,其中较为重要的是FGFR2突变。
2022年4月6日,信达生物公司的FGFR 1/2/3抑制剂佩米替尼片(Pemigatinib)已获国家药品监督管理局批准上市,成为国内首款获批上市的FGFR抑制剂。

2021年9月最新公布的pemigatinib在中国晚期胆管癌人群的2期研究结果显示:
在30例可评估的患者中,15例患者达到疾病缓解,客观缓解率(ORR)为50%,疾病控制率(DCR)为100%。此外,pemigatinib也表现出了良好的安全性。
其实早在2020年4月17日,FDA就加速批准Incyte公司Pemazyre(pemigatinib),用于治疗既往接受过治疗的携带成纤维细胞生长因子受体2(FGFR2)融合或重排的局部晚期或转移性胆管癌患者,批准时间比预定的5月30日审批日期提前了一个半月,这也是FDA批准的首个胆管癌靶向疗法。
Pemigatinib是针对FGFR亚型1/2/3的强效选择性口服抑制剂,在既往临床研究中已证实该药物对FGFR基因突变的肿瘤细胞具有选择性的药理学活性。此药二线治疗胆管癌患者的有效率ORR达35.5%,疾病控制率DCR为82%,成为胆管癌历史上第一个靶向药物!具有划时代的意义!
在FIGHT-202试验中共纳入146例经过1线治疗的晚期胆管癌患者,分为3个队列:A是FGFR2融合/重排(107例),B是其他FGFR突变(20例),C是非FGFR突变(18例),1例患者未定。所有患者均接受Pemigatinib治疗(13.5mg,每天1次,用2周歇1周)。
结果显示,A组客观缓解率(ORR)为35.5%,其中3例(2.8%)患者完全缓解(CR),35例(32.7%)患者部分缓解(PR),50例(46.7%)患者疾病稳定,疾病控制率为82%。B组和C组的ORR为0%。相比其他两个队列,队列A的患者对药物有效响应的比例大很多,有效时间也长得多。
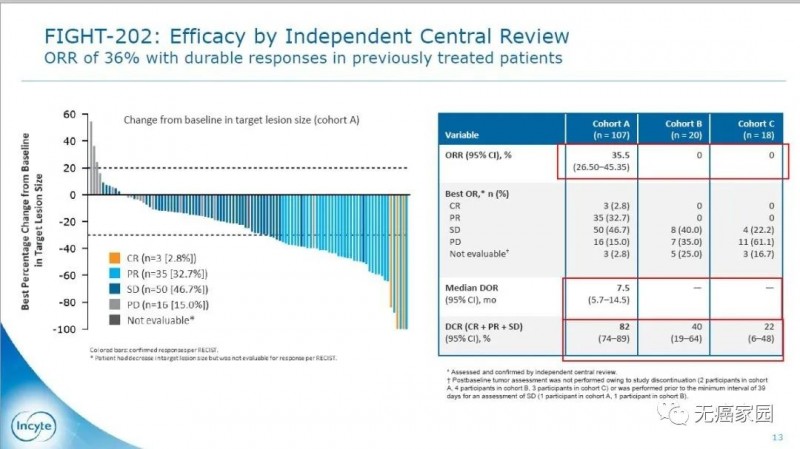
A组的DOR中位数为7.5个月,PFS和OS中位数分别为6.9和21.1个月。相比其他两个队列,生存期得到大幅度延长,意味着的患者用Pemigatinib治疗效果非常不错。
在安全性方面,pemigatinib的不良事件的发生率和其他选择性FGFR抑制剂类似,整体上耐受性好,毒副作用可控。
FGF/FGFR通路的异常激活可以使肿瘤细胞以自给自足的方式维持生长,所以FGFRs成为肿瘤治疗的新靶点。临床数据显示,胆管癌中有13%~20%的患者携带FGFR2融合。
因此,胆管癌患者若想要采用pemigatinib治疗首先需要确定是否携带FGFR2基因突变,想要进行基因检测的癌友们详情可以咨询无癌家园医学部,若是做过基因检测的癌友可以将检测报告提交给医学部进行病情评估。
首个获批上市的FGFR靶向药:厄达替尼
Balversa (Erdafitinib,厄达替尼) 是一款 FGFR1~4 酪氨酸激酶抑制剂,具有抗肿瘤活性。它是首款被FDA批准的口服FGFR抑制剂。2019年4月,FDA加速批准厄达替尼用于治疗携带有FGFR3或FGFR2突变的铂类化疗后疾病进展的局部晚期或转移性膀胱癌成人患者,包括新辅助或辅助铂化疗12个月内的患者。
其获批是基于一项II期临床试验BLC2001的结果,其中,87例晚期FGFR基因突变的膀胱癌患者接受靶向治疗后,客观缓解率为32.2%:完全缓解率2.3% + 部分缓解率29.9%。目前,该试验的更新数据显示,99例晚期FGFR基因突变的膀胱癌患者接受靶向治疗后,客观缓解率为40%:完全缓解率3% + 部分缓解率37%。
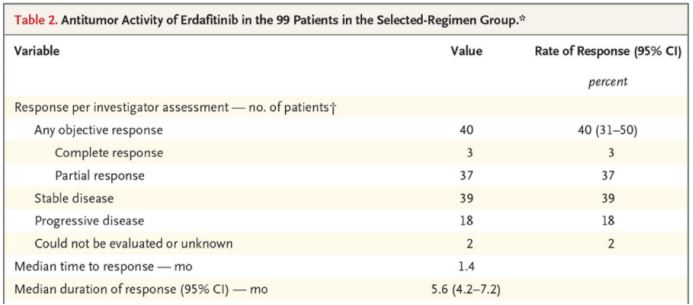
BLC2001临床试验更新后数据在既往接受过免疫治疗的22例患者中,客观缓解率为59%。中位无进展生存期为5.5个月,中位总生存期为13.8个月。
对于厄达替尼,另一项纳入187例晚期实体瘤的一期临床试验,也值得关注:26例膀胱癌患者,有效率为46.2%;疗效维持的中位时间为5.6个月;11例胆管癌患者,有效率为27.3%,疗效维持的中位时间为11.4个月。除已获批的临床适应症外,在研的临床适应症还有非小细胞肺癌、胃癌、食管癌、胆管癌、多发性骨髓瘤等。
第三款FGFR靶向药:Infigratinib
Infigratinib(BGJ398,Truseltiq)是最早开启临床试验的FGFR靶向药之一,可以算是业内的元老级靶向药。2021年5月29日,FDA宣布批准Infigratinib(Truseltiq)上市,用于治疗曾经接受过治疗的FGFR2融合及重排突变的局部晚期或转移性胆管癌患者。
此项批准基于一项2期临床研究数据,共纳入108例既往至少接受过一次治疗的FGFR2阳性晚期胆管癌患者。
结果显示,接受Infigratinib治疗的患者中,客观缓解率为23%,中位无进展生存期7.3个月;发生响应的患者中,缓解持续超过6个月的患者占32%,中位缓解持续时间5.0个月。中位总生存期为12.2个月。该研究中,Infigratinib的安全性和耐受性良好。
延伸:Infigratinib治疗肺鳞癌,疾病控制率达47.6%
Infigratinib是针对FGFR1~3的小分子抑制剂。在其I期临床试验研究,纳入了21例FGFR1扩增的肺鳞癌患者,治疗剂量为100mg/d或更高,17例患者疗效可评估,其中部分缓解3例,7例患者疾病稳定;疾病控制率为47.6%。
在研的FGFR靶向药物
除上述三种已经上市的药品外,还有10多款泛FGFR抑制剂处于不同临床开发阶段的候选药物。
第二代FGFR靶向药:Futibatinib
Futibatinib(TAS-120)是第二代的FGFR靶向药,用于治疗经一代FGFR抑制剂治疗后耐药的胆管癌患者。在 2018年,美国 FDA 授予了 Futibatinib 孤儿药资格(ODD)用于治疗胆管癌。2021 年 4 月 2 日,Futibatinib被美国FDA 授予突破性疗法认定,用于治疗经治局部晚期或转移性胆管癌。
2022年3月30日,据悉FDA已受理Futibatinib用于既往接受过治疗、携带FGFR2融合(包括基因融合)的局部晚期或转移性胆管癌的新药申请(NDA)。同时,FDA还授予该申请优先审评资格,预计最迟2022年9月30日会出结果。
此次新药申请是基于关键2b期临床研究FOENIX-CCA2 的积极结果,共纳入103例局部晚期或转移性肝内胆管癌患者作为研究对象。2021年4月AACR大会上公布的结果显示,futibatinib治疗的客观缓解率为41.7%。中位缓解持续时间为9.7个月,72%的缓解时间6个月,疾病控制率为82.5%,中位无进展生存期为9.0个月,中位总生存期为21.7个月,72%的患者在12个月时仍存活。
对肝癌有效,FGFR靶向新药:BLU-554
BLU-554是一种FGFR4的强效、选择性小分子抑制剂。一期临床数据显示,针对38例FGF19免疫组化阳性的肝癌患者,6例患者肿瘤明显缩小,客观缓解率16%,26例患者(68%)疾病稳定,18例(49%)患者肿瘤负荷减小。38例FGF19IHC+患者的最大肿瘤减小(根据靶病灶缩减衡量)见图。
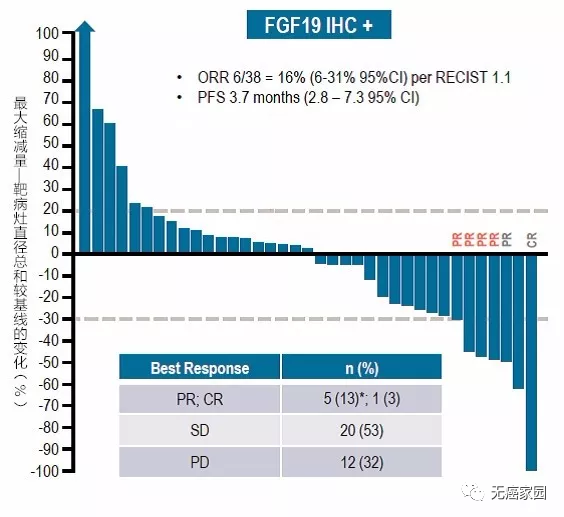
上述数据表明,BLU-554初步实现了对肝癌的 分而治之初衷,对肝癌的治疗有重要意义。
新兴泛FGFR抑制剂:Derazantinib
Derazantinib是一种强效、口服、靶向、泛-FGFR(成纤维细胞生长因子受体)抑制剂,对FGFR1、2、3具有很强的活性,目前正被开发用于治疗肝内胆管癌(iCCA)和其他有高频率FGFR突变的肿瘤类型。
在2022年美国临床肿瘤学会胃肠道肿瘤研讨会(ASCO GI)上公布了靶向抗癌药derazantinib治疗胆管癌FIDES-01 II期研究队列2的最新中期结果。该队列入组的是携带FGFR2基因突变或扩增的局部晚期或转移性肝内胆管癌(iCCA)患者。
在中期分析截止日期2021年8月31日,28例患者接受了治疗,其中23名患者有资格进行疗效评估,中位随访时间为5.2个月。根据研究者的评估,疾病控制率(DCR)为74%,包括确认客观缓解的2例患者和病情稳定的15例患者,其中大多数患者中观察到肿瘤缩小。中位无进展生存期(PFS)为7.3个月。
在2021年5月公布的FIDES-01 II期研究队列1(纳入103例GFR2阳性且已接受过至少一种化疗方案的肝内胆管癌患者)的数据显示,客观缓解率为21.4%,疾病控制率为74.8%,中位无进展生存期为7.8个月。
针对胃癌及胃食管交界部癌:Bemarituzumab
Bemarituzumab是一款同类首创抗体,作为针对FGFR2b过度表达的肿瘤靶向疗法,正在进行针对胃癌及胃食管交界部癌的开发。大约30%的HER2阴性胃食管癌患者会过度表达成纤维细胞生长因子受体2b(FGFR2b)。Bemarituzumab(Bema)是第一个也是唯一一个针对FGFR2b+肿瘤的研究性疗法。
2021年4月20日,FDA授予安进公司研发的Bemarituzumab突破性疗法称号,用于联合改良的FOLFOX6方案(mFOLFOX6),一线治疗FGFR2b阳性、HER2阴性的局部晚期或转移性胃及胃食管交界处癌患者。
FIGHT试验共入组155例未做过系统治疗的胃癌/胃食管交界处癌患者,分为bemarituzumab联合mFOLFOX6组、mFOLFOX6组。联合治疗组的中位无进展生存期为9.5个月,1年无进展生存率52.5%;对照组的中位无进展生存期为7.4个月,1年无进展生存率33.8%。
治疗胆管癌及实体瘤:ICP-192
ICP-192是一款具有全球自主知识产权的1类创新药,是可用于治疗多种实体瘤且具高选择性的小分子泛FGFR抑制剂,目前正在中国和美国开展多项临床研究。
2021年6月10日,gunagratinib(ICP-192)是获得美国FDA授予孤儿药资格,用于治疗胆管癌。
在2021年ASCO年会上,相关研究人员展示了泛 FGFR 抑制剂ICP-192在实体瘤患者中的最新临床数据。截至2021年2月,共有30例患者接受了ICP-192治疗。在完成至少一项肿瘤评估的12例FGF/FGFR基因突变患者中,总客观缓解率(ORR)为33.3%,其中1例完全缓解(CR),3例部分缓解 (PR),7例疾病稳定(SD)。疾病控制率(DCR)为91.7%。此外,ICP-192在安全性和耐受性方面表现良好,未达到最大耐受剂量(MTD)。
除了上述提到的药物外,还有很多在研FGFR抑制剂正在临床试验中,除了泛FGFR抑制剂,企业已开始布局FGFR4抑制剂。而且FGFR抑制剂的适应症更加广泛,除了胆管癌和尿路上皮癌,已扩大到肝细胞癌、胃和胃食管交界处癌以及间皮瘤等。
小编有话说
全球FGFR相关实体瘤的总体年发病人数从2016年的440万人增长到2020年的490万人,复合年增长率为3.0%,预计到2035年增长至680万人。中国的这一数字在2020年达到140万人,从2016年到2020年的复合年增长率为2.6%,预计到2035年达到约190万人。
FGFR在人类肿瘤中的异常表达与肿瘤的发展 、预后及耐药密切相关,因此发展靶向FGFR的抗肿瘤药物可以为其相关的癌症治疗提供新的有效的策略。
随着临床研究的深入开展,科学家们还发现FGFR基因扩增程度越高的患者,对于FGFR抑制剂的反应越好。这表明,FGFR不仅可以作为一个靶点,还有望成为疗效预测指标,市场空间巨大。
参考文献
1.https://pubmed.ncbi.nlm.nih.gov/26373574/
2.https://www.onclive.com/view/fda-approves-infigratinib-for-cholangiocarcinoma
3.https://www.onclive.com/view/derazantinib-continues-to-elicit-encouraging-responses-in-fgfr2-gene-fusion-positive-intrahepatic-cholangiocarcinoma
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。