时间:2023-02-28 14:46 编辑:全球肿瘤医生网
DS8201(优赫得、T-DXd、德曲妥珠单抗、Trastuzumab Deruxtecan、Enhertu)中国首个适应症:HER2阳性乳腺癌获批
乳腺癌患者的福音!多癌种战神DS8201终于在中国震撼上市
2023年2月24日,中国国家药监局(NMPA)官网最新公示,注射用德曲妥珠单抗(Enhertu)获批上市,用于治疗既往接受过一种或一种以上抗 HER2 药物治疗的不可切除或转移性 HER2 阳性成人乳腺癌患者。大名鼎鼎的DS8201终于在中国首次获批上市,同时也有了响当当的中文大名--优赫得!

药物名称:德喜曲妥珠单抗(trastuzumab deruxtecan,DS8201)
研发公司:阿斯利康;第一三共
药物介绍:DS8201(trastuzumab deruxtecan,T-DXd) ,是一种HER2抗体+伊立替康类化疗药物的偶联药物,属于ADC型药物类型(抗体偶联药物)。目前已在非小细胞肺癌,乳腺癌,胃癌中获批。2022年5月,DS8201在中国被正式纳入优先审评目录,用于治疗HER2低表达乳腺癌患者。
CDE受理时间:2022年5月
DS8201中国首个适应症:HER2阳性乳腺癌获批
乳腺癌是每个女性的噩梦,至今为止,它是全球妇女高发的恶性肿瘤之一,也是我国女性最常见恶性肿瘤。其中,HER2阳性约占全部乳腺癌的20%~25%,虽然赫赛汀的问世极大改善了HER2阳性乳腺癌患者的预后,但仍然面临到严峻的耐药问题,给这部分患者带来巨大的生存挑战,迫切需要新的治疗方案。
这一批准对中国乳腺癌界来说是重要的一天!
既往临床数据显示,截止2020年6月8日,DS8201治疗确认的总客观缓解率(ORR)为61.4%,其中12名患者出现完全缓解(病灶完全消失),疾病控制率(DCR)高达97.3%!
而此次获批是基于 DESTINY-Breast03 的3期试验 (NCT03529110) 的结果。
DESTINY-Breast03 是一项 3 期、多中心、开放标签、随机、头对头研究,比较 DS-8201与 T-DM1 (Kadcyla )的疗效和安全性。
结果显示:
与T-DM1相比,DS-8201 将人们癌症进展或死亡的风险降低了 72%*,几乎 83% 的人使用 DS-8201 缩小了肿瘤,而使用 T-DM1的患者仅有 36% 肿瘤缩小。
做了基因检测的病友可以拿出报告看看一旦存在HER2突变,可以马上联系全球肿瘤医生网医学部看看是否有机会接受国内新药治疗,看不懂的病友也可以致电全球肿瘤医生网医学部解读报告。
初识明星抗体偶联药物-DS8201
DS8201(trastuzumab deruxtecan,T-DXd) ,是一种HER2抗体+伊立替康类化疗药物的偶联药物,属于ADC型药物类型(抗体偶联药物)。它有两部分组成:第一部分是针对HER2靶点的抗体,可以精准的识别并且结合HER2高表达甚至低表达的肿瘤细胞;第二部分是剧毒的化疗药伊立替康。这种设计会使抗体带着化疗药去找肿瘤细胞,然后精准地给肿瘤细胞下毒,毒死它们。
这种药物设计结合了靶向药的精准和化疗药的高效,既避免了全身使用化疗药的毒副作用,也比单独使用靶向药具有更强的杀伤能力,一举两得。
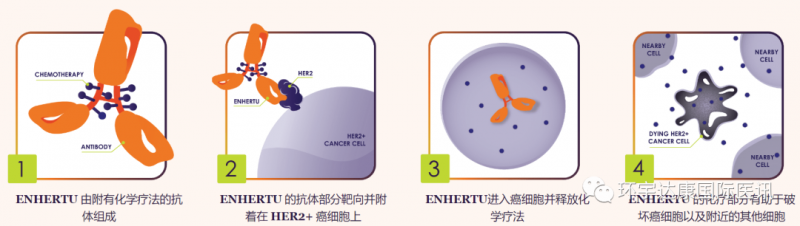
目前这款药物在非小细胞肺癌,乳腺癌,胃癌,结直肠癌等常见实体肿瘤中取得了卓越的战绩。
2019年12月21日,基于DESTINY-Breast01研究的惊艳数据,FDA正式批准DS-8201用于HER2阳性乳腺癌的后线治疗。
2021年1月,FDA批准DS8201用于经曲妥珠单抗治疗的HER2阳性局部晚期或转移性胃癌和胃食管结合部(GEJ)腺癌患者。
2022年8月,FDA批准DS-8201用于不可切除或转移性HER2-low的乳腺癌患者。
2022年8月11日,FDA批准DS-8201用于经治的HER2阳性非小细胞肺癌患者。
在代号为DESTINY-CRC01的结直肠癌研究中,经DS-8201单药治疗后,客观缓解率为45.3%,其中完全缓解率为1.9%,部分缓解率为43.4%,疾病控制率(DCR)达83.0%,这些优势将突破HER2阳性结直肠癌治疗的桎梏,为广大患者带来新希望。
对于国内乳腺癌患者来说,这款药物的上市无疑给病友们带来了提高疗效,延长生存期的更优治疗选择!
获益于精准治疗时代靶向药物的问世,乳腺癌已经有了众多新药刷新生存期。目前针对乳腺癌主要常见基因包括ER,HER2,PIK3CA,和AKT1,BRCA等,有众多新药研发如均在如火如荼地进行当中,想寻求新方案及其他国内外治疗新技术帮助,且经济条件允许的情况下,可提交病历至全球肿瘤医生网医学部初步评估。期待更多国研好药早日获批,落地医保,造福更多国内的肺癌患者。
此外,这款药物还给肺癌病友带来惊喜!目前国内一项评估Trastuzumab Deruxtecan(T-DXd,DS-8201)作为携带HER2突变的不可切除、局部晚期或转移性NSCLC患者一线治疗的有效性和安全性的开放性、随机、多中心、3期研究(DESTINY-Lung04)正式在国内招募患者啦!这意味着国内晚期非小细胞肺癌患者将率先有机会接受这款新药的免费治疗!
这些幸运的肺癌患者快来申请DS8201
●组织学证实非鳞状局部晚期、或转移性NSCLC
●受试者必须接受过局部晚期或转移性疾病的姑息性全身治疗
●经证实的合格HER2外显子19或20突变
●必须获取肿瘤组织样本,送至中心实验室进行检测
●至少有一个根据RECIST 1.1标准判断的可测量的病灶
注:以上仅为部分入组条件,具体要求请将基因检测报告,诊断报告电子版或拍照发送至doctor.huang@globecancer.com,邮件中留下联系方式,或直接致电医学部,医学部收到报告分析完毕后一个工作日内电话联系,为您全面分析检测报告,匹配能够入组的临床试验,以及有无新药可以使用
以前这些美国研发上市的抗癌新药对于国内的患者来说遥不可及,近两年随着国家的重视,加快了各类抗癌药物研发上市的审批速度,让更多国外的新药好药,也能造福国内的癌症患者。并且随着国家和相关部门的重视,相信更多效果好的抗癌药都会加快在我国上市和纳入医保的步伐,让更多的百姓获益,我们共同期待!
参考资料:https://www.enhertu.com/en/gastric/enhertu-for-her2-advanced-stomach-cancer
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。