时间:2024-03-04 16:29 编辑:全球肿瘤医生网
多款TCR-T细胞疗法全力打击多种实体肿瘤
在研的实体瘤TCR-T细胞疗法
除了在研的血液瘤产品外,还有多款TCR-T产品值得期待,剑指胰腺癌、黑色素瘤、肉瘤等多款实体瘤,目前在研靶点详见下图。下面小编简单盘点一下其中的佼佼者,以供参考!
▼早期TCR-T产品覆盖的肿瘤适应证
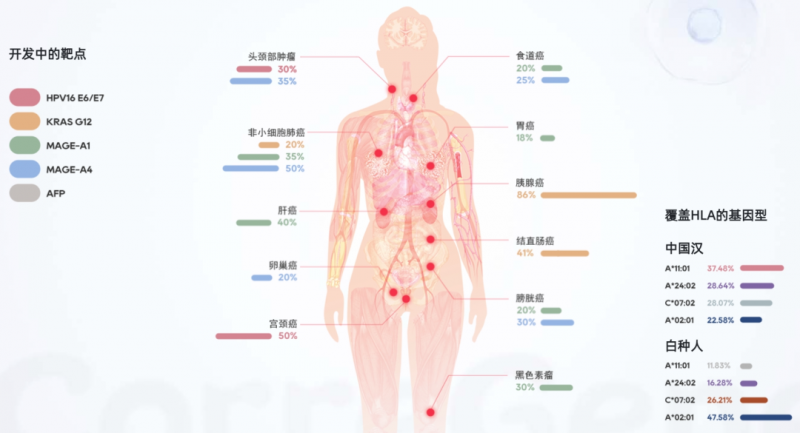
▲图源CorreGene,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
黑色素瘤克星-Kimmtrak,首款获批的TCR-T产品
2022年1月25日,首款TCR-T细胞产品Kimmtrak(IMCgp100,tebentafusp-tebn),获美国食品和药物管理局(FDA)批准,用于治疗成年不可切除或转移性葡萄膜黑色素瘤(HLA-A*02:01阳性)。
KIMMTRAK的获批是基于3期IMCgp100-202临床试验结果,该研究共入组378名HLA-A*02:01阳性转移性葡萄膜黑色素瘤患者,并将其随机分为两组(2:1),一组为KIMMTRAK组(N=252),接受Kimmtrak治疗;另一组为对照组(N=126),给予伊匹单抗、派姆单抗或达卡巴嗪治疗)。结果如下:
1、中位总生存期(OS):21.7个月(KIMMTRAK组)vs 16个月(对照组);
2、中位无进展生存期(PFS):3.3个月(KIMMTRAK组)vs 2.9个月(对照组);
3、1年总生存率:73.2%(KIMMTRAK组)vs 58.5%(对照组)。
总之,上述数据显示,与对照组相比,Kimmtrak单药治疗显著降低了葡萄膜黑色素瘤的病情进展或死亡风险,使其降低27%。
胰腺癌:TCR-T治疗部分缓解率高达72%
一例71岁进行性转移性胰腺癌患者,既往接受手术及放化疗后,病情持续进展,癌细胞已扩散至肺部。不过幸运的是。该患者基因检测发现,体内存在一种KRAS的突变蛋白,这也为该患者后续接受靶向KRASG12D的TCR-T治疗,提供了可能。患者入组后,见接受了托珠单抗+环磷酰胺的预处理治疗,之后再接受TCR-T治疗。
结果显示,TCR-T治疗后第21天,患者的血小板计数和绝对中性粒细胞得以恢复;治疗第1个月的计算机断层扫描显示,患者肺转移病灶消退;治疗后6个月,部分缓解(PR)率高达72%!
图1 胰腺癌患者TCR-T治疗前后,胸部计算机断层扫描对比图
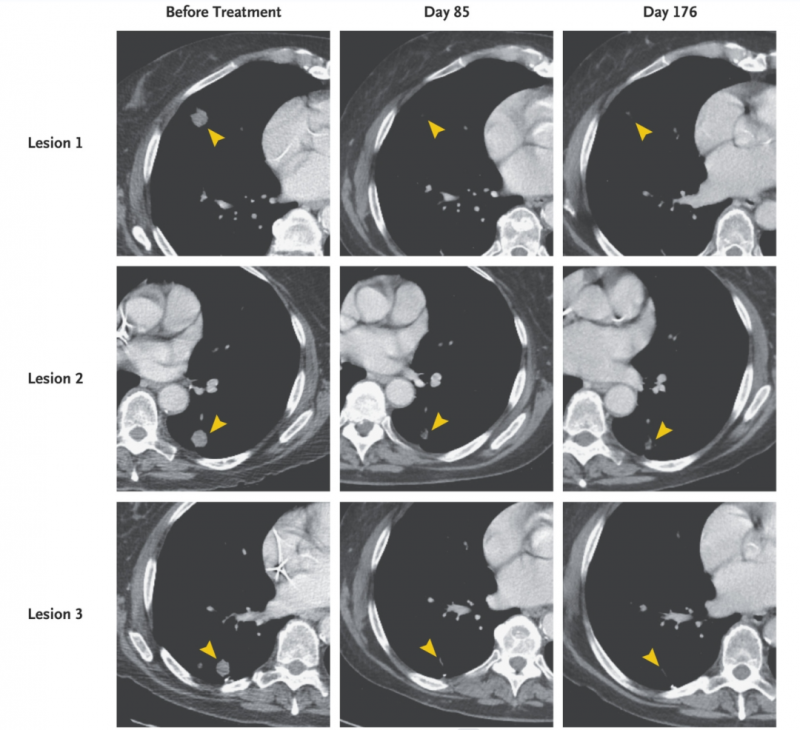
▲图源NEJM,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
乙肝病毒相关肝细胞癌:SCG101具有抗癌及抗病毒双重功效
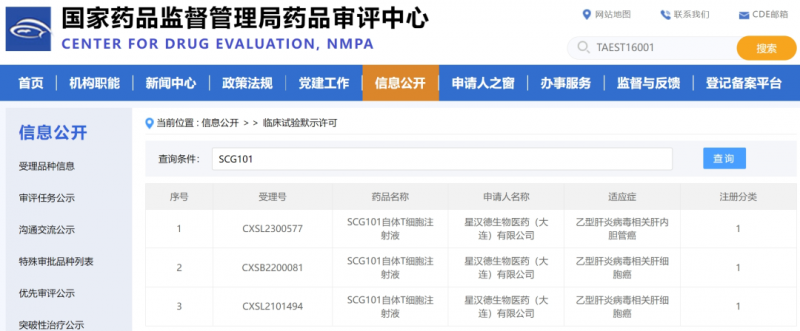
▲图源NMPA官网
SCG101是由星汉德生物公司研发的一款TCR-T细胞产品,并在2022年3月,获中国国家药品监督管理局(NMPA)新药临床研究批准。
SCG101是一种乙肝抗原特异性的TCR-T细胞疗法,既能有效清除HBV-HCC肿瘤细胞、HBV-DNA整合的癌前病变细胞,达到抗癌的效果;同时还能清除HBV感染细胞,实现抗病毒的功效,可谓一箭双雕!
一项关于SCG101治疗乙型肝炎病毒(HBV)相关肝细胞癌(HCC)的临床研究,共纳入1例HBV相关的肝细胞癌患者,入组后仅接受单剂SCG101输注,而未接受其他抗肿瘤治疗,结果显示如下:
1、肿瘤缓解:患者在治疗第28天,达到部分缓解(PR),肿瘤靶病灶相比基线缩小66%,并在治疗第4个月进一步缩小至74.5%;同时另一处病灶完全消失。截至数据统计时,该患者肿瘤未进展时间已超过6.9个月。
图2 HBV相关肝细胞癌患者,回输SCG101前后影像学变化
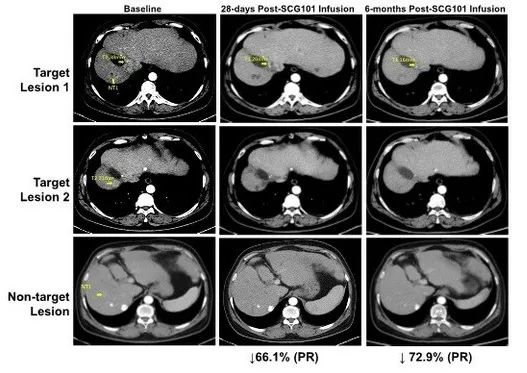
▲图源CISION,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、HBV感染缓解:该患者在回输SCG101前后,肝脏免疫组化结果显示,乙肝表面抗原阳性肝细胞达到100%清除;HBsAg(HBV血清学标志)水平,也从治疗前的557.96 IU/mL,下降至1.3 IU/mL(回输SCG101第7天)、0.08 IU/mL(回输第28天)。
图3 回输SCG101前后,HBsAg值变化
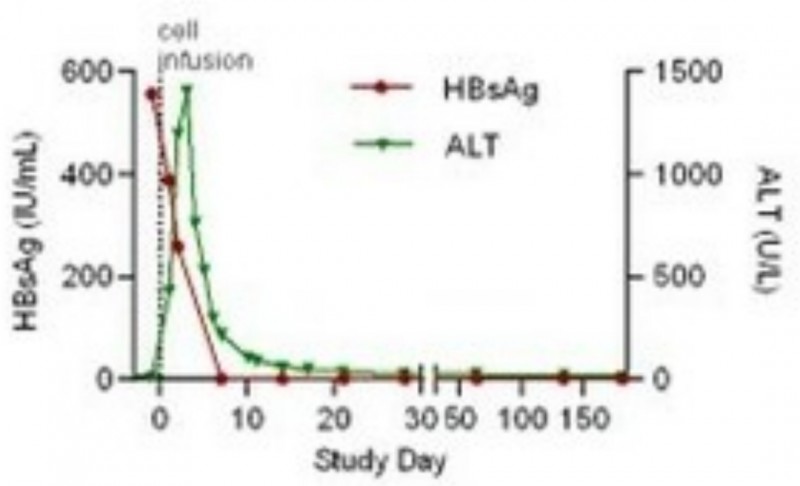
▲图源CISION,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
如何寻求个性化癌症疫苗帮助
目前正有几款TCR-T疗法,在招募乙型肝炎病毒相关肝细胞癌、妇科恶性肿瘤(卵巢癌、子宫内膜癌、宫颈癌)、头颈部肿瘤等患者开展临床试验。
想参加的病友可将近期病理包括、出院小结、治疗经历等资料,提交至医学部,进行初步评估!
滑膜肉瘤:TAEST16001初战告捷,疾病控制率达83.3%
TAEST16001是由我国香雪生命科学技术公司自主研发的一款TCR-T细胞产品,TAEST16001治疗晚期软组织肉瘤的Ⅰ期临床试验结果惊艳!
本次研究共纳入12例HLA-A*02:01阳性且表达NY-ESO-1的晚期软组织肉瘤患者(滑膜肉瘤10例,脂肪肉瘤2例)。58.3%(7/12)为男性,,中位年龄为33(25-67)岁。此外,83.3%的患者既往至少接受过2种化学药物治疗。入组后,在给予改良淋巴细胞清除术后,输注TAEST16001细胞治疗。经过为期43天的中位随访,结果显示:
1、缓解时间:中位缓解时间(TTR)为1.9个月,中位缓解持续时间为13.1个月。
2、客观缓解率(ORR):ORR为41.7%(95%CI,15.272.3)。
3、部分缓解(PR)率:12例患者中有5例获得部分缓解,PR率为41.67%。
4、疾病控制率:5例[41.7%(95%CI,15.272.3)]患者疾病稳定,疾病控制率为83.3%(95%CI,51.697.9)。
5、中位无进展生存期(PFS):PFS为7.2个月(95%CI,2.511.8)。
综上,9例(75%)患者显示肿瘤消退,6例(50%)患者在第一次放射学评估后肿瘤负荷持续下降。让我们期待这款TCR-T疗法的后续临床研究成果!
图4 单个可评估患者的最佳临床反应
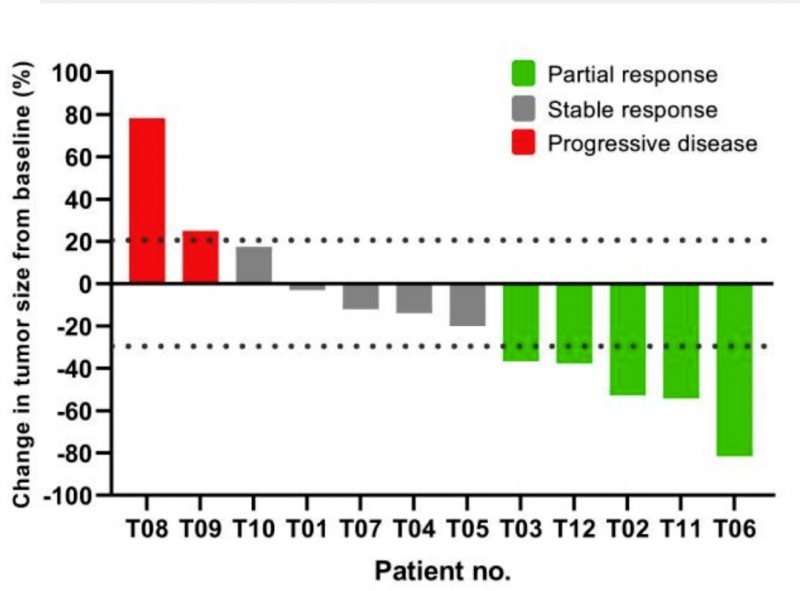
▲图源Cell Rep Med,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
我国TCR-T研发全面开花,精准打击多款癌种
截至目前,TCR-T细胞免疫疗法已在部分实体肿瘤治疗中,取得了较满意的疗效,尤其是对黑素瘤、肝癌、滑膜细胞肉瘤等实体瘤的治疗效果较为明显。作为细胞免疫治疗的热门赛道之一,TCR-T细胞治疗产品已吸引了多家药企布局,目前我国也有多款TCR-T产品新药IND获批,期待能早日迎来我国自主研发的TCR-T上市的好消息!
TC-N201注射液
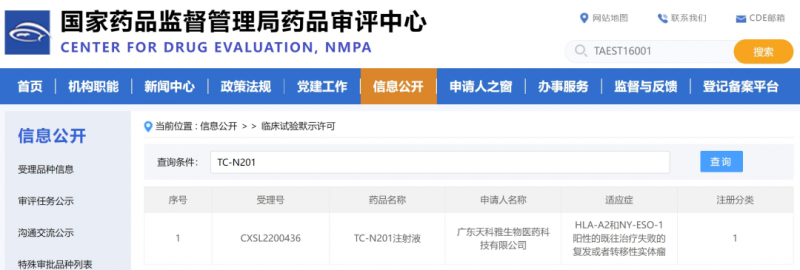
▲图源NMPA官网
2022年11月28日,由广东天科雅生物医药科技公司研发的一款TCR-T产品TC-N201注射液的临床试验申请(IND),获国家药监局审查中心批准,用于治疗既往治疗失败的复发或者转移性实体瘤(LA-A2和NY-ESO-1阳性)。
TAEST1901

▲图源NMPA官网
2022年4月20日,由香雪生命科学研发的一款创新型TCR-T产品TAEST1901注射液,获中国国家药监局(NMPA)的临床试验许可,拟用于治疗晚期肝癌或其它晚期肿瘤(HLA-A*02:01、肿瘤抗原AFP表达阳性)。
CRTE7A2-01
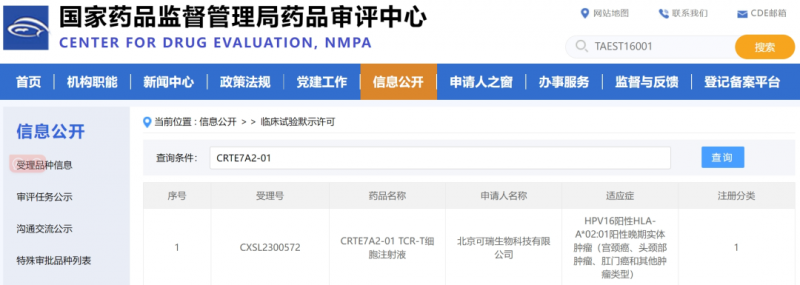
▲图源NMPA官网
2023年8月25日,北京可瑞生物科技有限公司研发的一款TCR-T细胞注射液CRTE7A2-01的临床新药IND获国家药品审评中心批准,拟用于治疗头颈部肿瘤、HPV16阳性晚期宫颈癌等多款实体瘤。
研究显示,CRTE7A2-01有良好的抗肿瘤活性,可通过靶向抑制HPV16 E7突变的表达,防治细胞向恶性方向转化。此前该药已通过FDA临床申请(NCT05122221),预计将于2024年11月完成I期试验。
小编寄语
TCR-T疗法作为一种新型的抗肿瘤方案,具有归巢能力强、安全性良好等优点,在黑色素瘤、非小细胞肺癌、肝癌、滑膜肉瘤等多款实体瘤治疗领域,取得了不俗的成绩。本次随着TSC-100和TSC-101Ⅰ期临床结果的公布,也让我们看到了TCR-T疗法在血液肿瘤领域的应用潜力。各国对TCR-T疗法的研发热度持续攀升,我国包括来恩生物、星汉德、百吉生物、香雪生命、天科雅等多家企业也已进入到临床研究阶段,目前最快已推进到2期临床研究阶段,我们也期望未来会有越来越多的TCR-T细胞产品问世,造福更多的患者!
如果您也想寻求TCR-T细胞疗法或国内外其他治疗新技术的帮助,可先将治疗经历、病理报告等相关资料,提交至医学部,进行初步评估。
参考资料
[1]Al Malki M M,et al.Initial Results of a Phase 1 Trial of TSC-100 and TSC-101, Engineered T Cell Therapies That Target Minor Histocompatibility Antigens to Prevent Relapse after Allogeneic Hematopoietic Cell Transplantation[J].Blood,2023,142:2090.
https://ashpublications.org/blood/article/142/Supplement+1/2090/500034/Initial-Results-of-a-Phase-1-Trial-of-TSC-100-and
[2]Nayar R,et al. 156 Discovery of TSC-100: A natural HA-1-specific TCR to treat leukemia following hematopoietic stem cell transplant therapy[J]. 2020.
https://jitc.bmj.com/content/8/Suppl_3/A94
[3]Pan Q,et al.Phase 1 clinical trial to assess safety and efficacy of NY-ESO-1-specific TCR T cells in HLA-A02:01 patients with advanced soft tissue sarcoma. Cell Rep Med. 2023 Aug 15;4(8):101133.
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10439245/
[4]https://markets.ft.com/data/announce/full?dockey=1330-9052919en-62GP5TO6D9ULFSTC04EREDQ9VU
[5]https://corregene.com/index.php?m=contentc=indexa=listscatid=10
[6]https://hk.prnasia.com/story/406654-2.shtml
[7]https://www.nejm.org/doi/full/10.1056/NEJMoa2119662
[8]https://www.cde.org.cn/
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。