时间:2024-07-01 15:00 编辑:全球肿瘤医生网
斯坦福大学证实CAR-T细胞免疫疗法疾病控制率达91.3%,治疗前列腺癌、肝癌、结直肠癌等安全有效
近日,斯坦福医学院进行了一项关于CAR-T细胞疗法安全性的大型临床研究显示,经CAR-T细胞治疗后,出现继发性癌症的风险较低,为晚期难治性癌症患者带来了一线生机!近年来,更是涌现出多款新型CAR-T疗法,从多角度、多技术层面,一次次挑战CAR-T治疗实体瘤的技术壁垒,为前列腺癌、肝癌、结直肠癌等多款实体瘤患者,带来新的希望与选择!
斯坦福大学:CAR-T安全有效,继发性癌症风险较低

▲截图源自Stanford MEDICINE官网
据斯坦福大学官网数据,研究人员针对2016~2024年间,724例在斯坦福医疗保健中心接受CAR-T细胞治疗患者的组织和血液样本进行分析,并经过为期3年的随访。
结果显示,仅有1例患者出现T细胞淋巴瘤,继发性血癌的发病率仅为6.5%左右,且与CAR-T细胞本身无关,该患者在初次确诊癌症前,就有数年的自身免疫性疾病病史。
综上,CAR-T细胞疗法为高风险、难治性癌症患者提供了新的曙光,且继发性癌症的风险较低。这也是近年来CAR-T多次登上ASCO、《Nature》等顶级盛会或期刊的原因之一,有望为血液肿瘤及实体瘤患者博得一线生机!
三款新型CAR-T疗法,向前列腺癌、胃肠道肿瘤等发起猛攻
PSCA-CAR-T:晚期前列腺癌的救命稻草,胰腺转移灶消退
前列腺癌又被称为免疫沙漠,因其肿瘤内部无大量的T细胞,既往很难用免疫疗法治疗。前列腺干细胞抗原(PSCA)在前列腺癌中高度表达,且随着疾病进展而增加,在疾病晚期尤其是伴有骨转移的情况下表达更高。
近期,世界知名期刊《自然医学(nature medicine)》报道了一项利用新型PSCA-CAR T细胞疗法,治疗前列腺癌的初次人体1期临床试验(NCT03873805)。本次研究共入组14例PSCA阳性的转移性去势抵抗性前列腺癌(mCRPC)患者,癌细胞已扩散至前列腺以外,且对激素治疗产生耐药性,此时临床已无适合他们的更好疗法。入组接受CAR-T回输治疗后,结果显示:
1、生存率:在DL1、DL2和DL3组中,患者的6个月生存率分别为33%、67%、40%。其中,1例患前列腺癌伴胰腺转移的患者,在输注PSCA-CAR T前后,复查CT扫描显示,输注前测量的病灶大小为40.224.8mm;输注后1个月病变消退,无法测量(详见下图)。
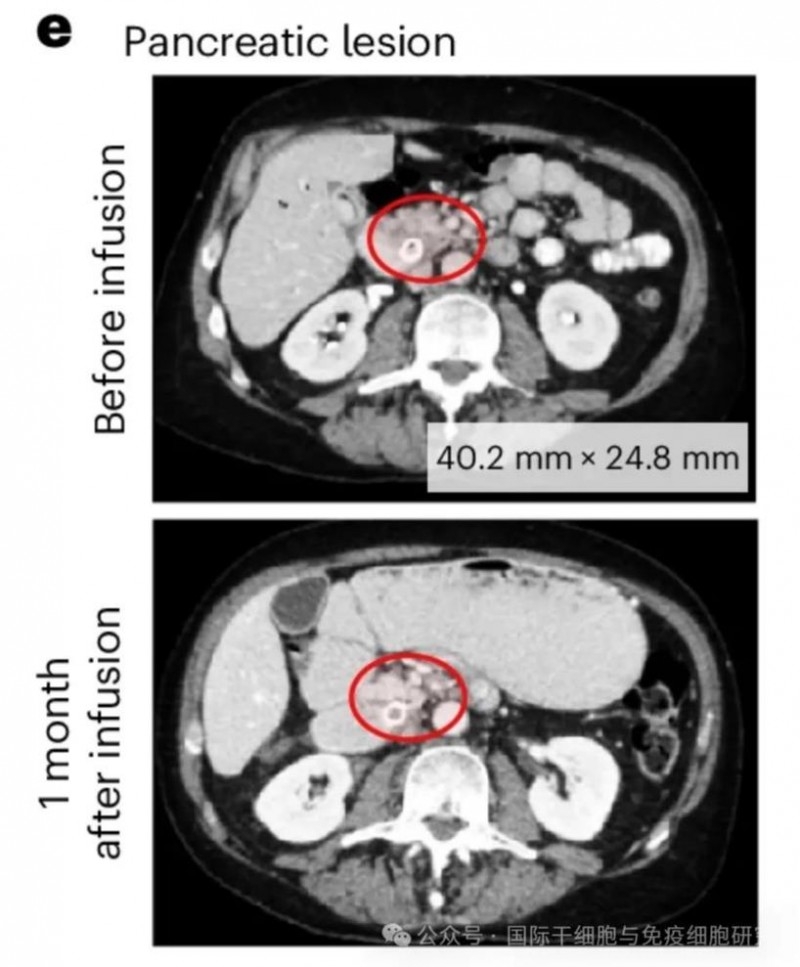
▲图源Nature Medicine,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、前列腺特异性抗原(PSA)水平下降:从治疗前到CAR-T细胞输注后第28天,DL1组(n=1)、DL2组(n=3)、DL3组(n=3)中,均有多名患者出现特异性抗原(PSA)水平下降表现。其中,4名患者PSA下降幅度超过30%(详见下图)。值得一提的是,DL2组中,有1例患者PSA下降幅度更是超过90%。
图1 CAR-T细胞输注后28天内,最佳的PSA反应
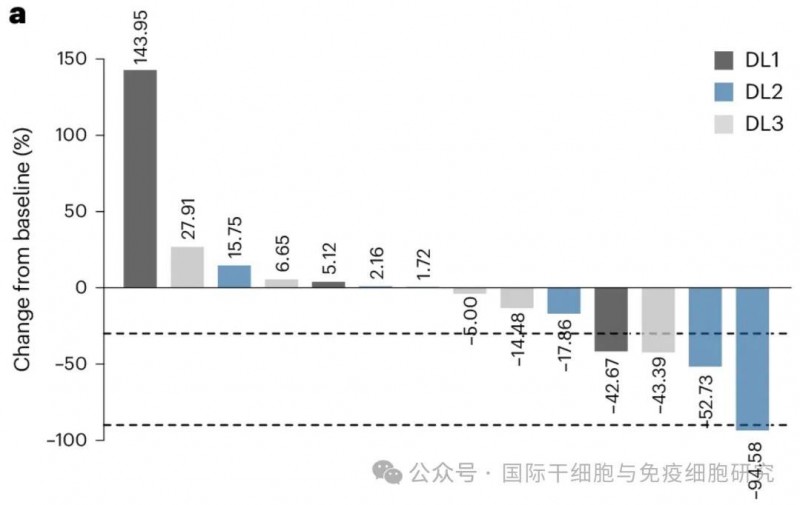
▲图源Nature Medicine,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
好消息是,目前有多款CAR-T细胞的临床试验正在招募患者,主要针对胃癌、胰腺癌、肝癌、结直肠癌、卵巢癌、间皮瘤、B细胞淋巴瘤、非霍奇金淋巴瘤、T细胞淋巴瘤、T细胞白血病(T-ALL)等多款癌种。
想参加的癌友,可将完整的病理检查报告、影像学检查报告、治疗经历等资料,提交至医学部,进行初步评估。
GPC3 CAR-T亮剑晚期肝细胞癌,疾病控制率竟达91.3%
在刚刚结束的2024年ASCO大会上,一款针对肝细胞癌的新型GPC3 CAR-T细胞疗法(C-CAR031),引起了热烈反响。GPC3在肝癌细胞表面过度表达,但在正常细胞中低表达,是肝细胞癌治疗中极具潜力的靶点。
C-CAR031治疗晚期肝细胞癌(HCC)的I期临床研究(NCT05155189),共纳入24例既往接受过3.5种(中位数)全身治疗方案的晚期肝细胞癌患者,其中83%的患者伴有肝外转移。入组后,相继接受标准淋巴细胞清除治疗、C-CAR031回输治疗。结果显示:
1、疾病控制率(DCR):所有患者的疾病控制率高达91.3%!这也意味着,超90%的患者在CAR-T治疗后,肝内及肝外肿瘤病灶出现缩小表现。
2、肿瘤缩小率:肿瘤中位缩小率(Tumor Size Reductions)达42.2%(范围:-28.1%~94.4%)。
3、客观缓解率(ORR):所有剂量水平患者的客观缓解率(ORR)达到56.5%。其中接受最高剂量C-CAR031治疗的患者(n=7),其ORR更是高达75.0%。
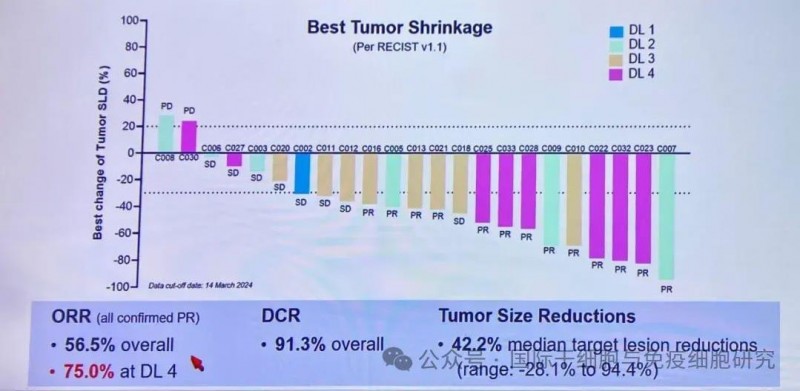
▲图源ApexOnco,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
CEA CAR-T细胞:剑指多款CEA阳性实体瘤,肿瘤持续缓解5个月
癌胚抗原(CEA)是一种与胃肠道癌症相关的糖蛋白,是胃肠道肿瘤的敏感的生物标志物,在结直肠癌等胃肠道肿瘤中广泛表达,是CAR-T疗法的有力靶点。在2024年ASCO大会上,公布了缺氧反应性CEA CAR-T细胞的1期临床研究结果,并表现出良好且持久的抗肿瘤反应。
本次研究共入组40例复发/难治性CEA阳性实体瘤患者,包括结肠直肠癌(35例)、胃癌(3例)、胆道癌(1例)、非小细胞肺癌(1例)。在淋巴细胞清除后,通过腹膜内输注(n=16)或静脉输注(n=24)方式,回输CEA CAR-T细胞。结果显示如下:
1、客观缓解率(ORR):ORR为25%(腹腔内注射) vs 8%(静脉注射)。其中,腹腔内注射最高剂量CAR-T细胞组的患者(n=7),临床反应最佳,部分缓解率(PR)达28.6%(2例),且这两名患者肿瘤持续缓解均超过5个月,其中1名患者在6个月的随访中,靶病变肿瘤负荷更是减少了76%。
2、疾病控制率(DCR):DCR为88%(腹腔内注射) vs 67%(静脉注射)。
小编寄语
CAR-T细胞疗法在治疗血液肿瘤中的成绩有目共睹,中美等国更是先后有多款产品获批上市。但CAR-T在实体瘤治疗领域的应用则一直受限,可能与实体瘤恶劣的微环境有关。
近年来,研究人员正在不断尝试新的方法,来增强肿瘤微环境中的CAR-T细胞活性。比如,本文中提到的CEA CAR-T细胞,在利用胃肠道癌症的缺氧肿瘤微环境来提高疗效的同时,又不会影响安全性。此外,研究人员也在积极探索将CAR-T细胞与射频消融、放射疗法等其他抗癌手段相结合,以增强抗癌效果。小编也期望,在各国抗癌专家的不断努力下,终能打破实体瘤治疗瓶颈,让越来越多的癌症患者获益。
对当前治疗方案存疑,或想寻求CAR-T、TCR-T、TIL、癌症疫苗等国内外新兴抗癌技术帮助的病友,可将出院小结、病理报告、治疗经历等资料,提交至医学部,详细评估病情或申请国内外抗癌专家会诊。
参考资料
[1]Dorff T B,et al. PSCA-CAR T cell therapy in linkstatic castration-resistant prostate cancer: a phase 1 trial[J]. Nature Medicine, 2024: 1-9.
https://www.nature.com/articles/s41591-024-02979-8
[2]https://www.oncologypipeline.com/apexonco/asco-2024-astrazenecas-gpc3-secret-sauce
[3]https://dailynews.ascopubs.org/do/phase-1-studies-novel-autologous-car-t-cell-therapies-show-promise-gi-cancers
[4]https://dailynews.ascopubs.org/do/phase-1-studies-novel-autologous-car-t-cell-therapies-show-promise-gi-cancers
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。