时间:2024-08-01 14:53 编辑:全球肿瘤医生网
2024年上半年全球获批上市的CAR-T细胞疗法有哪些
2012年,世界首例急性淋巴细胞白血病患儿艾米莉,经接受CAR-T细胞治疗获得临床治愈,并实现无癌生存12年后,CAR-T这款新型免疫细胞疗法一战成名,瞬间引爆抗癌圈。
如今CAR-T疗法更是迎来井喷式发展,成为了各国尖端抗癌研发领域的必争之地,仅2024上半年,全球就有四款CAR-T产品获批临床,为癌症患者带来希望的曙光!下面全球肿瘤医生网医学部小编就来盘点一下这几款新鲜出炉的CAR-T疗法,以供癌友们参考!
2024上半年全球获批上市的四大CAR-T疗法
Breyanzi:治疗白血病、淋巴瘤的多面手,完全缓解率高达72.3%
药品信息
01、药物名称
Breyanzi(liso-cel,利基迈仑赛,lisocabtagene maraleucel)。
02、药物介绍
Breyanzi是一种针对CD19的转基因自体CAR-T细胞疗法。
03、上市时间
2024年3月15日。
04、研发公司
百时美施贵宝公司。
获批适应证
1、慢性淋巴细胞白血病或小淋巴细胞淋巴瘤

▲截图源自cancernetwork
2024年3月15日,美国食品药品监督管理局(FDA)已批准Breyanzi,用于治疗成人复发或难治性(R/R)慢性淋巴细胞白血病(CLL)、小淋巴细胞淋巴瘤(SLL),这些患者既往接受过至少2种治疗(包括BCL-2抑制剂、BTK抑制剂)。
本次获批是基于1/2期TRANSCEND CLL 004临床试验(NCT03331198)的结果,该研究结果显示,Breyanzi治疗CLL、SLL的总体缓解率达到45%,完全缓解率(CR)达到20%,总体中位缓解时间(DOR)为35.3个月。此外,该药在清除微小残留病灶中的成绩依然亮眼,血液中微小残留病灶(MRD)阴性率高达100%,骨髓中MRD阴性率也高达92.3%!
2、套细胞淋巴瘤

▲截图源自FDA官网
2024年5月30日,美国FDA批准Breyanzi,用于治疗成年复发或难治性套细胞淋巴瘤(MCL),这些患者既往接受过包括1种BTKi抑制剂在内的至少两种治疗方法,Breyanzi也成为了目前治疗B细胞恶性肿瘤最为广泛的CAR-T细胞疗法!
本次获批是基于TRANSCEND NHL 001的临床研究(NCT02631044)结果,该研究共入组104例复发或难治性套细胞淋巴瘤(MCL)患者,这些患者既往接受过至少两线治疗,包括BTKi、CD20靶向药、烷化剂。在可评估疗效的83例患者中,经过为期16.1个月(0.4~60.5)的中位随访,结果显示如下:
①客观缓解率(ORR):在疗效组(n=83,DL1+DL2),客观缓解率(ORR)高达83.1%(95%CI,73.3~90.5)。
②完全缓解率(CR):完全缓解(CR)率高达72.3%(95%CI,61.4~81.6)。
③中位总生存期(OS):中位OS为18.2个月(95%CI,12.9~36.3)。其中,在达到完全缓解的患者中,中位OS更是长达36.3个月(详见下图).
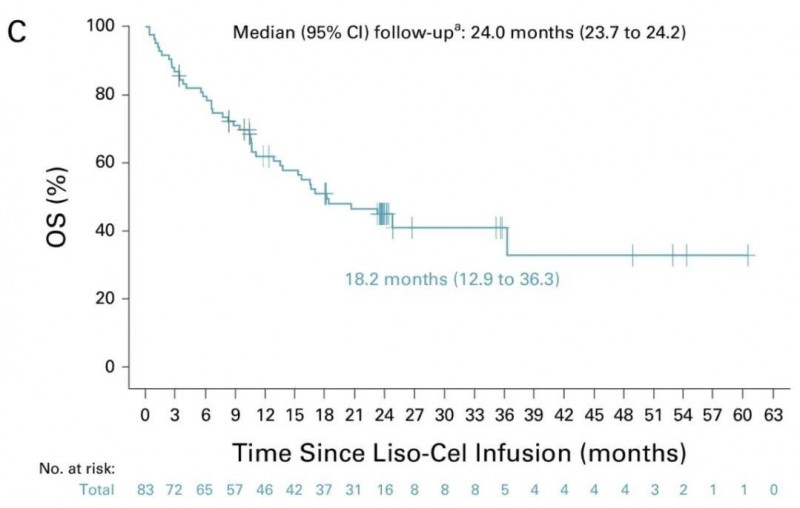
▲图源ASCO Publications,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
④中位无进展生存期(PFS):中位无进展生存期长达15.3个月(95%CI,6.6~24.9),详见下图。
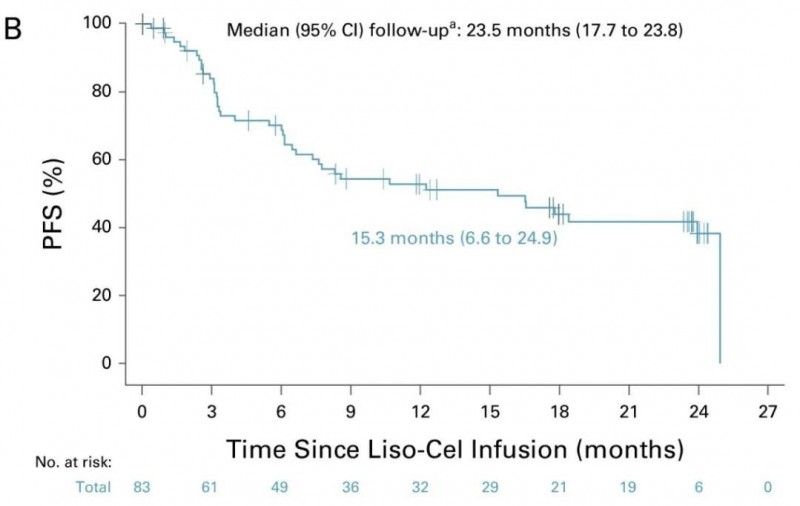
▲图源ASCO Publications,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
⑤中位缓解持续时间(DOR):中位DOR达到15.7个月(95%CI,6.2~24.0)
综上,Breyanzi在治疗既往接受过大量治疗的复发或难治性套细胞淋巴瘤中,表现出高CR率和深度持久的反应,且安全性可控,感染、3级细胞因子释放综合征(CRS)等严重不良反应的发生率较低。
如何寻求CAR-T疗法的帮助
目前有多款CAR-T细胞的临床实验急招癌症患者,主要针对以下靶点及癌种:
①GPC3:用于治疗肝癌;
②GUCY2C:用于治疗结直肠癌;
③PSMA:用于治疗前列腺癌等;
④EGFRvII:用于治疗头颈部肿瘤、神经胶质瘤等;
⑤Claudin18.2:用于治疗胰腺癌、胃癌等;
⑥MUC-1:用于治疗肺癌、肝癌、胰腺癌、胃癌等;
⑦间皮素(mesothelin):用于治疗胰腺癌、肺癌、结肠癌、卵巢癌、间皮瘤等;
⑧CEA:用于治疗肺癌、胰腺癌、结肠癌、胃癌、乳腺癌等;
⑨B7-H3:用于治疗髓母细胞瘤、尤文肉瘤、横纹肌肉瘤、肾母细胞瘤、神经母细胞瘤、特别难以治疗的脑干肿瘤(DIPG)等。
做过基因检测的癌友,可自行查看检测报告,一旦发现上述突变,可将近期病理检查结果、基因检测报告、治疗经历等资料,提交至医学部,初步评估是否有机会接受CAR-T疗法的帮助。
Abecma:多发性骨髓瘤疾病进展或死亡风险降低51%
药品信息
01、药物名称
Abecma(ide-cel,Idecabtagene vicleucel)。
02、药物介绍
Abecma是一种针对BCMA靶点的CAR-T细胞疗法,主要用于多发性骨髓瘤的治疗,它也是全球首个抗BCMA CAR-T细胞疗法!
03、上市时间
2024年4月4日。
04、研发公司
百时美施贵宝/蓝鸟生物公司。
获批适应证

▲截图源自onelive
Abecma早在2021年3月26日,就已获得FDA批准,用于复发/难治性多发性骨髓瘤的治疗。2024年4月4日,其适应证再次扩大,被美国FDA批准,用于成年既往接受过2种治疗[包括抗CD38单克隆抗体、蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)]的复发或难治性多发性骨髓瘤的治疗。
本次获批是基于3期KarMMa-3临床试验(NCT03651128)的结果,本次研究共入组386例患者,被随机分配为两组,即Abecma CAR-T治疗组(254例)、标准治疗组(132例),结果显示如下:
1、中位无进展生存期(PFS):Abecma组(n=254)的中位PFS为13.3个月(95%CI,11.8~16.1),而标准治疗组(n=132)的中位PFS仅为4.4个月(95%CI,3.4~5.9,HR,0.49)。显然,Abecma组的无进展生存时间更长。此外,6个月的无进展生存(PFS)率为73%(Abecma组) vs 40%(标准治疗组);而12个月的无进展生存(PFS)率则为55%(Abecma组) vs 30%(标准治疗组)。疾病进展或死亡的风险比,0.49;95% CI,0.38~0.65,相当于将疾病进展或死亡风险降低了51%!
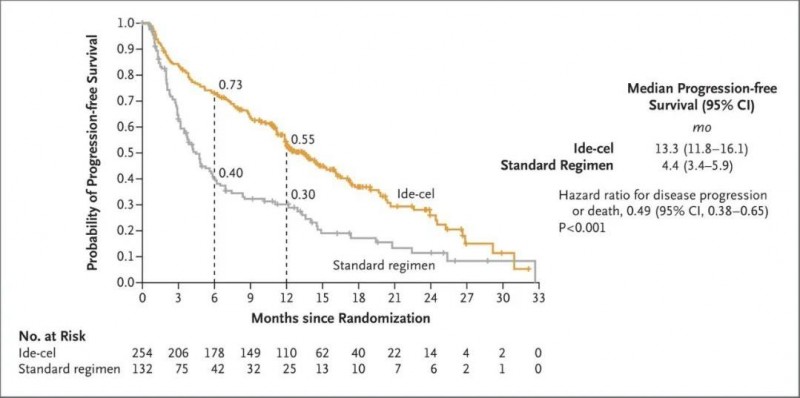
▲图源N Engl J Med,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、总体缓解率(ORR):与标准治疗组相比,Abecma组的总体缓解率显著改善,总体缓解率(ORR)为71%(Abecma组) vs 42%(标准治疗组)。此外,Abecma组有39%的患者达到完全或严格完全缓解(CR),而标准方案组仅有5%。
西达基奥仑赛:多发性骨髓瘤总体缓解率高达84.6%
药品信息
01、药物名称
西达基奥仑赛(cilta-cel,Carvykti)。
02、药物介绍
西达基奥仑赛是传奇生物和强生创新制药联合研发的一款靶向BCMA的CAR-T细胞疗法。
03、上市时间
2024年4月5日。
04、研发公司
传奇生物。
获批适应证

▲截图源自onelive
2024年4月5日,西达基奥仑赛获得美国FDA批准,用于成年复发或难治性多发性骨髓瘤(R/R MM)的治疗。这些患者对来那度胺(Revlimid)有耐药性,且既往接受过包括蛋白酶体抑制剂(PI)、免疫调节剂(IMiD)在内的至少一线治疗。
本次获批是基于3期CARTITUDE-4的临床研究(NCT04181827)结果,将入组患者随机分为两组,即西达基奥仑赛组(176例)、标准治疗组[接受PVd(28例地塞米松、硼替佐米、泊马度胺),或DPd(183例,达雷木单抗、泊马度胺、地塞米松)治疗]。经过15.9个月(0.1~27.3)的中位随访,结果显示:
1、总体缓解率:总体缓解率为84.6%(西达基奥仑赛组) vs 67.3%(标准治疗组)。
2、完全缓解(CR)率:与标准治疗组相比,西达基奥仑赛组有更多患者获得完全缓解,CR率为73.1%(西达基奥仑赛组) vs 21.8%(标准治疗组)。
3、无进展生存(PFS)率:12个月的无进展生存(PFS)率分别为75.9%(西达基奥仑赛组)vs 48.6%(标准治疗组),详见下图。
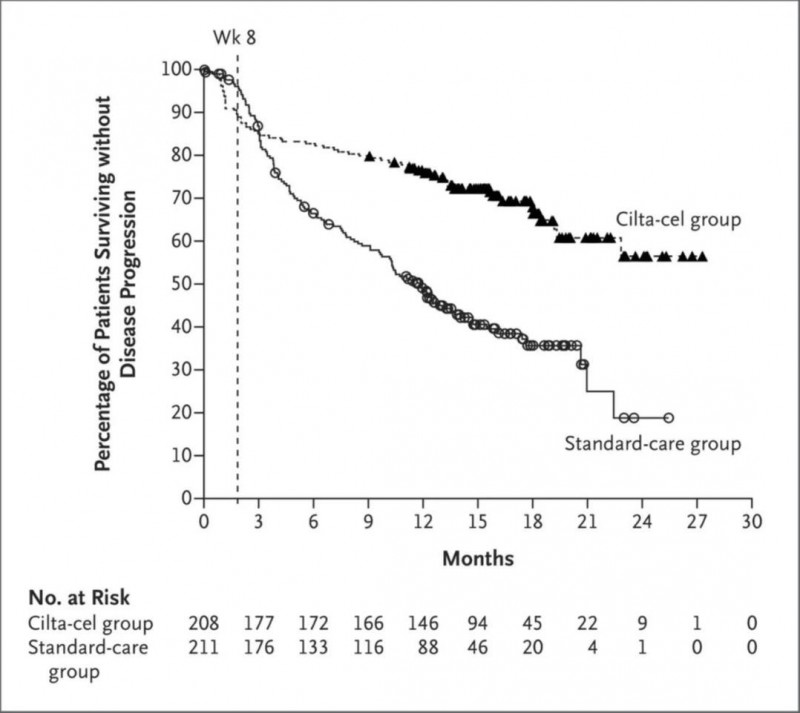
▲图源N Engl J Med,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
4、微小残留病灶:在治疗期间,西达基奥仑赛组60.6%的患者、标准治疗组15.6%的患者MRD呈阴性。
综上,对于既往接受过1~3种治疗的难治性多发性骨髓瘤患者,西达基奥仑赛单次回输可降低疾病进展或死亡风险。
泽沃基奥仑赛:中国第五款CAR-T,多发性骨髓瘤中位PFS长达25.0个月
药品信息
01、药物名称
泽沃基奥仑赛(zevor-cel,Zevorcabtagene Autoleucel,赛恺泽,产品编号CT053)。
02、药物介绍
泽沃基奥仑赛是一款靶向BCMA的自体CAR-T细胞产品,
03、上市时间
2024年3月1日。
获批适应证

▲截图源自NMPA
2024年3月1日,中国国家药品监督管理局(NMPA)正式下达通知,批准泽沃基奥仑赛注射液的新药上市申请,用于成年患者复发或难治性多发性骨髓瘤的治疗,这些患者既往接受过包括1种免疫调节剂、蛋白酶体抑制剂在内的至少3线治疗。
本次获批主要是基于在中国进行的一项LUMMICAR STUDY 1 Ⅰ/Ⅱ期临床试验(NCT03975907)的结果。该研究共入组14例中位年龄为54岁的复发或难治性多发性骨髓瘤(R/R MM)患者,在接受淋巴细胞清除+泽沃基奥仑赛治疗后,经过长达3年(37.7个月)的随访,结果显示:
1、无进展生存期(PFS):所有患者的中位PFS长达25.0个月(14.9,不可评估[NE]),sCR/CR患者的中位PFS为26.9个月(15.5,NE)(详见下图)。
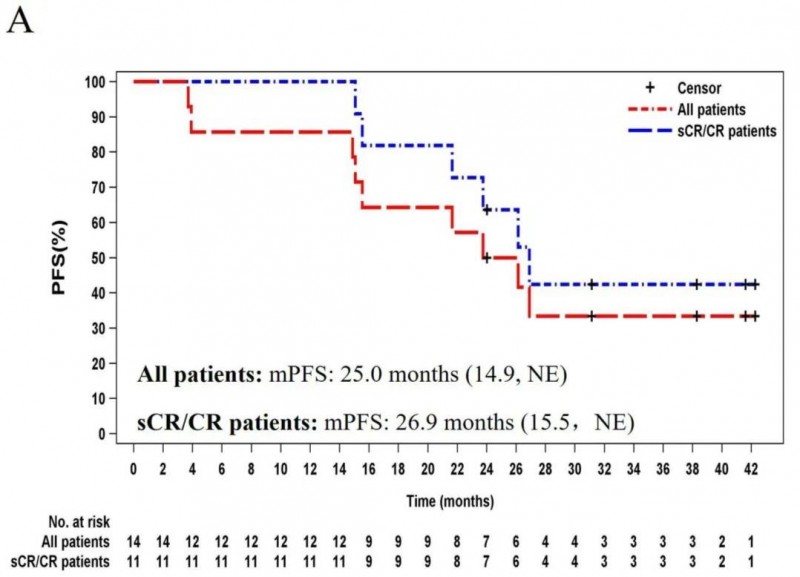
▲图源ScienceDirect,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
2、客观缓解率(ORR):入组患者的客观缓解率(ORR)高达100%(14/14)!其中,21.4%(3例)的患者达到部分缓解(PR);78.6%(11例)的患者达到完全缓解(CR)或严格完全缓解(sCR)。
综上,泽沃基奥仑赛在治疗复发或难治性多发性骨髓瘤(R/R MM)方面,保持了深度和持久的反应,且安全性良好。
小编寄语
CAR-T细胞疗法作为免疫细胞疗法中的佼佼者,其在血液肿瘤中的治疗效果有目共睹,中美等国更是有多款产品相继获批上市。值得欣慰的是,近年来研究人员开始将研发重点集中在CAR-T治疗实体瘤方面,并取得了不俗的成绩。近年来,CAR-T研发更是进入了百家争鸣的局面,仅2024上半年就有四款CAR-T产品在中美等国获批上市,助癌症患者从黑暗走向光明!
目前我国有多款CAR-T细胞疗法的临床试验相继开展,并有幸运患者获得完全缓解!感兴趣的病友可将影像学检查、近期病理报告、基因检测报告、治疗经历等资料,提交至医学部,详细评估病情或申请国内外抗癌专家会诊!
参考资料
[1]Wang M,et al.Lisocabtagene Maraleucel in Relapsed/Refractory Mantle Cell Lymphoma: Primary Analysis of the Mantle Cell Lymphoma Cohort From TRANSCEND NHL 001, a Phase I Multicenter Seamless Design Study. J Clin Oncol. 2024 Apr 1;42(10):1146-1157.
https://pubmed.ncbi.nlm.nih.gov/38072625/
[2]Rodriguez-Otero P,et al.Ide-cel or standard regimens in relapsed and refractory multiple myeloma[J]. New England Journal of Medicine, 2023, 388(11): 1002-1014.
https://www.nejm.org/doi/full/10.1056/NEJMoa2213614
[3]San-Miguel J,et al.Cilta-cel or standard care in lenalidomide-refractory multiple myeloma[J]. New England Journal of Medicine, 2023, 389(4): 335-347.
https://www.nejm.org/doi/full/10.1056/NEJMoa2303379
[4]Fu C,et al.Three-Year Follow-up on Efficacy and Safety Results from Phase 1 Lummicar Study 1 of Zevorcabtagene Autoleucel in Chinese Patients with Relapsed or Refractory Multiple Myeloma[J]. Blood,2023, 142(Supplement 1): 4845-4845.
https://www.sciencedirect.com/science/article/abs/pii/S0006497123114467
[5]https://www.onclive.com/view/fda-approves-ide-cel-for-triple-class-exposed-r-r-multiple-myeloma
[6]https://www.cancernetwork.com/view/fda-approves-liso-cel-for-relapsed-refractory-cll-sll
[7]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-lisocabtagene-maraleucel-relapsed-or-refractory-mantle-cell-lymphoma
[8]https://www.onclive.com/view/fda-approves-cilta-cel-for-r-r-multiple-myeloma-who-have-received-at-least-one-prior-line-of-therapy
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。