时间:2024-09-18 15:14 编辑:全球肿瘤医生网
2024年9月12日FDA批准了PD-(L)1抑制剂Tecentriq Hybreza上市
2024年9月12日,一款皮下注射的PD-(L)1抑制剂Tecentriq Hybreza,获美国食品药品监督管理局(FDA)批准,它是首个也是目前唯一一个皮下抗PD-(L)1癌症免疫疗法。此前该药已于2023年8月,在英国获得首次全球批准,目前已在50多个国家/地区获批上市。
Tecentriq Hybreza可在约7分钟内进行皮下注射,而传统的Tecentriq(阿替利珠单抗)的标准静脉输注则需要30~60分钟,大大提高了治疗效率、减少了患者治疗过程中的不适感。
▲截图源自FDA官网
Tecentriq Hybreza:7分钟完成治疗的神奇抗癌药
调查显示,相较于静脉给药,大多癌症患者更喜欢皮下给药,因其治疗时间短、不适感更低且更易于给药。为了提高治疗便利性和医疗效率,罗氏公司研发了这款Tecentriq Hybreza皮下注射使用的复合制剂,它由阿替利珠单抗[一种针对PD-(L)1的单克隆抗体,旨在防止癌症免疫逃逸]+重组人透明质酸酶PH20组成。适用于成人所有Tecentriq静脉注射适应症,包括非小细胞肺癌(NSCLC)、小细胞肺癌(SCLC)、肝细胞癌(HCC)、黑色素瘤、肺泡软组织肉瘤(ASPS)等。
Tecentriq Hybreza本次获FDA批准,主要基于ⅠB/Ⅲ期IMscin001研究(NCT03735121)的关键数据。本次研究共入组371例局部晚期或转移性非小细胞肺癌(NSCLC)成年患者,既往未接受过癌症免疫治疗,且一线铂类治疗失败,中位年龄为64.0岁(范围:27-85 岁)。按2∶1的比例随机分为两组,即阿替利珠单抗SC(接受阿替利珠单抗+透明质酸酶皮下注射)、阿替利珠单抗IV(阿替利珠单抗静脉注射)。
结果显示:阿替利珠单抗SC组的客观缓解率(ORR)为12%,中位无进展生存期(PFS)为2.8个月(95%CI 2.1-3.1个月)。而阿替利珠单抗IV组的ORR为10%,PFS为2.9个月(95%CI 1.7-4.2个月)。
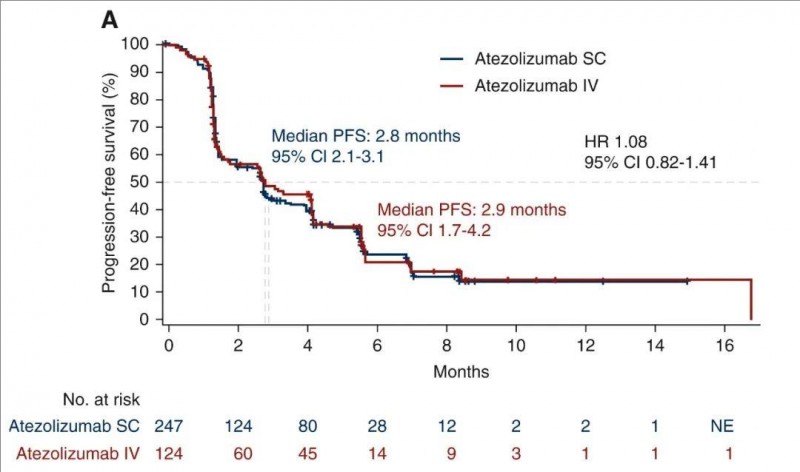
▲图源ESMO,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
该研究显示,皮下注射时Tecentriq在血液中的浓度相当,且其安全性和有效性与静脉注射制剂一致。
小编寄语
过去十年间,癌症的靶向免疫治疗已经取得了长足的进展,除了上面获批的药物,还有更多的抗癌新药正在研发,大大提升了晚期癌症患者的生存期!而且诸如Tecentriq Hybreza这类创新药的出现,也让患者能在7分钟内完成皮下注射治疗,相较于动辄需要30~60分钟的静脉注射治疗,患者的治疗时间大幅缩短!小编也期望未来会有更多的抗癌新药获批上市,亦或是纳入医保范畴,让越来越多的癌症患者获益!
参考资料
[1]Burotto M,et al.IMscin001 Part 2: a randomised phase III, open-label, multicentre study examining the pharmacokinetics, efficacy, immunogenicity, and safety of atezolizumab subcutaneous versus intravenous administration in previously treated locally advanced or linkstatic non-small-cell lung cancer and pharmacokinetics comparison with other approved indications[J]. Annals of Oncology, 2023, 34(8): 693-702.
https://www.annalsofoncology.org/article/S0923-7534(23)00694-4/fulltext
[2]Shen L,et al.172P Trastuzumab deruxtecan (T-DXd) in Chinese patients (pts) with previously treated HER2-positive locally advanced/linkstatic gastric cancer (GC) or gastroesophageal junction adenocarcinoma (GEJA): Primary efficacy and safety from the phase II single-arm DESTINY-Gastric06 (DG06) trial[J]. Annals of Oncology, 2023, 34: S1542-S1543.
https://www.annalsofoncology.org/article/S0923-7534(23)04513-1/fulltext
[3]Zhang L.Ivonescimab combined with chemotherapy in patients with EGFR-mutant non-squamous non-small cell lung cancer who progressed on EGFR-TKIs treatment: a randomized, double-blind, multi-center, phase 3 trial (HARMONi-A study)[J]. 2024.
https://meetings.asco.org/abstracts-presentations/232409
[4]https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-atezolizumab-and-hyaluronidase-tqjs-subcutaneous-injection?utm_medium=emailutm_source=govdelivery
[5]https://www.onclive.com/view/t-dxd-wins-conditional-approval-in-china-for-pretreated-her2-gastric-gej-cancer
[6]https://www.onclive.com/view/ivonescimab-under-priority-review-by-china-s-nmpa-for-frontline-pd-l1-positive-nsclc
[7]https://www.onclive.com/view/china-s-nmpa-grants-breakthrough-therapy-designation-to-9mw2821-in-advanced-urothelial-cancer
[8]https://www.onclive.com/view/ibi363-receives-fda-fast-track-designation-for-advanced-linkstatic-melanoma
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。