时间:2024-11-28 11:34 编辑:全球肿瘤医生网
2024年11月27日国家药监局批准TROP2 ADC药物芦康沙妥珠单抗(SKB264、佳泰莱、Sacituzumab Tirumotecan、sac-TMT)用于三阴性乳腺癌
2024年11月27日,我国第一款国产TROP2 抗体偶联药物(ADC)芦康沙妥珠单抗,获中国药品监督管理局(NMPA)批准上市!用于既往至少接受过2种系统治疗(其中至少1种治疗针对晚期或转移性阶段)的不可切除的局部晚期或转移性三阴性乳腺癌成人患者的治疗。
这是中国首个获得完全批准上市的国产ADC药物,同时也是第一个在中国获批上市的国产TROP2 ADC药物!标志着我国ADC抗癌新药研发领域又迈出了重要一步,具有里程碑式的意义!

▲截图源自KELUN-BIOTECH
三阴性乳腺癌Ⅲ期临床结果惊艳,6个月无进展生存率超43%
芦康沙妥珠单抗本次获批主要是基于一项Ⅲ期OptiTROP-Breast01临床研究(NCT05347134)的积极结果,该结果已在2024年美国临床肿瘤学会(ASCO)年会上公布。
本次研究共入组263例中位年龄为51岁的局部复发或转移性三阴性乳腺癌(TNBC)患者,其中至少有一种针对转移性疾病(其中87%存在内脏转移);且既往曾接受过两种或两种以上治疗(其中,26%接受过PD-1/PD-L1抑制剂治疗;48%因晚期疾病接受过3种化疗)。入组后,将这些患者随机分为两组,即SKB264组(n=130,接受芦康沙妥珠单抗治疗)、化疗组(n=133,接受长春瑞滨、吉西他滨、艾日布林或卡培他滨)。结果显示如下:
1、客观缓解率(ORR):通过盲法独立中央审查(BICR)评估的客观缓解率(ORR)分别为43.8%(SKB264组) vs 12.8%(化疗组)。
2、中位无进展生存期(PFS):与化疗组相比,接受芦康沙妥珠单抗治疗的患者无进展生存期(PFS)显著改善至5.7个月(95%CI,4.3至7.2);而化疗组仅为2.3个月(95%CI,1.6至2.7)。此外,6个月PFS率分别为43.4%(SKB264组) vs 11.1%(化疗组)。
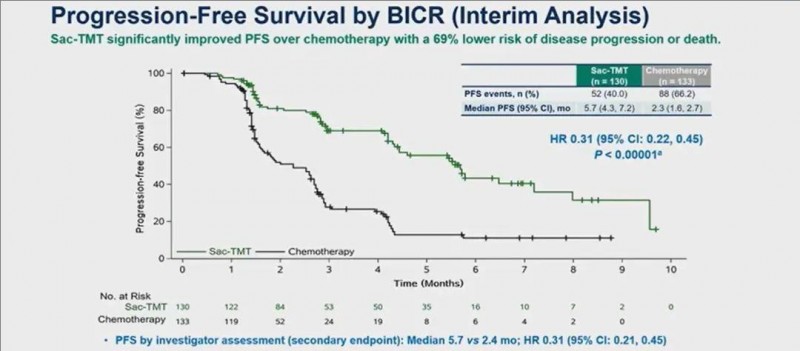
▲图源ASCO,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
3、中位总生存期(OS):经过10.4个月的中位随访,SKB264组未达到中位OS(95%CI,11.2至NE),而化疗组仅为9.4个月(95%CI,8.5至11.7)。显然,SKB264(芦康沙妥珠单抗)组的中位总生存期(OS)具有统计学显著优势(HR0.53;95%CI,0.36至0.78;P=0.0005)(详见下图)。
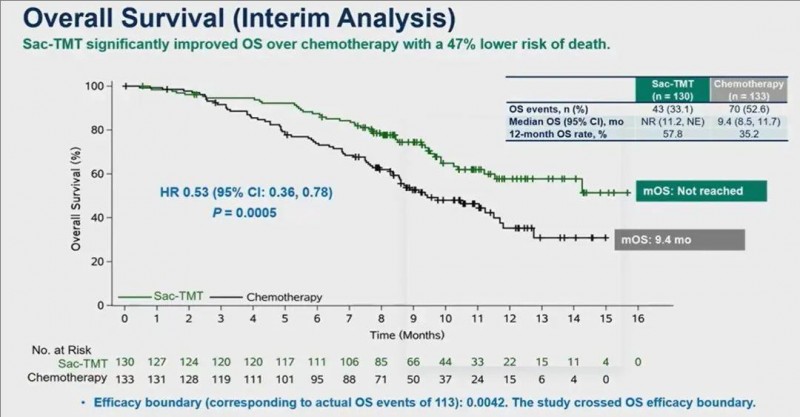
▲图源ASCO,版权归原作者所有,如无意中侵犯了知识产权,请联系我们删除
芦康沙妥珠单抗:肺癌/乳腺癌的克星
芦康沙妥珠单抗(SKB264,Sacituzumab Tirumotecan,sac-TMT,佳泰莱)是科伦博泰自主研发的一款靶向TROP-2的抗体偶联药物(即ADC药物),针对乳腺癌(BC)、非小细胞肺癌(NSCLC)、妇科肿瘤、胃癌(GC)等多款晚期实体瘤。
芦康沙妥珠单抗的抗癌原理
芦康沙妥珠单抗通过重组抗TROP2人源化单克隆抗体,特异性识别肿瘤细胞表面的TROP2,其后被肿瘤细胞内吞,并于细胞内释放KL610023。KL610023作为拓扑异构酶I抑制剂,可诱导肿瘤细胞DNA损伤,进而导致细胞周期阻滞、细胞凋亡。此外,还可在肿瘤微环境中,释放具有细胞膜渗透性的KL610023,可通过旁观者效应,杀死邻近的肿瘤细胞,最终达到抗癌的目的。
芦康沙妥珠单抗还有两大适应证上市在望,剑指肺癌
除了本次获批的三阴性乳腺癌外,芦康沙妥珠单抗还有两个适应证的上市申请,已获得中国国家药监局药品审评中心(NMPA)的受理,并被纳入优先评审资格,这些适应证分别为:
1、用于既往接受EGFR-TKI+含铂化疗失败的局部晚期或转移性EGFR突变的非小细胞肺癌的治疗,该适应证于2024年8月申报,有望在明年第三季度获批。
2、用于经EGFR-TKI治疗后病情进展的EGFR突变的局部晚期或转移性非小细胞肺癌成年患者的治疗,该适应症证2024年10月31日申报!
喜讯!国内多家癌症中心启动芦康沙妥珠单抗临床招募
相信看了上面的数据,癌友们对芦康沙妥珠单抗这款抗癌新药印象深刻!好消息是目前我国正在开展芦康沙妥珠单抗治疗局部晚期或转移性实体瘤的临床研究,现已有大量患者通过全球肿瘤医生网抗癌新药招募中心,成功入组接受这款抗癌新药的治疗!
新药简介
①药品名称:芦康沙妥珠单抗(SKB264)。
②研发公司:科伦博泰生物。
适应证
适用于二线失败或标准治疗失败的Ⅰ期或Ⅱ期实体瘤、头颈鳞癌、胃食管交界处腺癌、胃腺癌、子宫内膜癌等。
招募信息(部分)
1)年龄18岁,性别不限。
2)经组织学确诊的无法根治的局部晚期或转移性上皮来源的恶性肿瘤患者,目前可以筛头颈,胃、子宫内膜、尿路上皮癌四种(注:TROP2评估不会在入组前进行,入组前无需通过免疫组织学或其他方法确认TROP2表达水平,但是申办方要求收集活检或存档肿瘤组织样本来测定TROP2表达水平)。
3)受试者必须有通过电子计算机断层扫描(CT)或磁共振成像(MRI)检测的可测量病灶。
4)所有经标准治疗失败,或无标准治疗方案,或现阶段不适用标准治疗的不可手术切除的局部晚期或转移性实体瘤。
5)中性粒细胞计数(NEUT)1.5109/L,血小板计数(PLT)100109/L;血红蛋白浓度9.0g/dL。
申请流程
想申请芦康沙妥珠单抗临床试验的患者,需将近期基因检测报告、病理报告等资料汇总后,提交至医学部,进行初步评估。我们的专家将为您全面分析解读检测报告,并匹配适合患者入组的临床试验项目。注:全球肿瘤医生网作为国内权威的肿瘤患者服务平台,我们承诺对所有患者的个人信息保密,并承诺在整个过程中,遵循国家临床研究的相关法律法规。
小编寄语
近年来,我国抗癌新药的研发速度,正以前所未有的中国速度迈向世界前列!尤其是经历三代技术变革的ADC药物,可在杀伤癌细胞的同时,避免损伤周围正常组织或细胞。随着芦康沙妥珠单抗的正式获批,标志着我国在ADC药物的研发领域迈出了重要的一步,为乳腺癌、肺癌等晚期实体瘤患者带来了新的希望与选择!对现有治疗方案存疑或想参加方舟计划获得免费用药机会的患者,可将近期影像学及病理检查报告、治疗经历等资料,提交至医学部,进行初步评估或了解详细的入排标准。
参考资料
[1]Xu B,et al.Sacituzumab tirumotecan (SKB264/MK-2870) in patients (pts) with previously treated locally recurrent or linkstatic triple-negative breast cancer (TNBC): Results from the phase III OptiTROP-Breast01 study[J]. 2024.
https://ascopubs.org/doi/10.1200/JCO.2024.42.16_suppl.104
[2]https://kelun-biotech.com/
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。