时间:2020-11-10 16:39 编辑:全球肿瘤医生网
RX208临床试验,晚期恶性实体肿瘤BRAF V600E基因突变靶向药I期临床试验
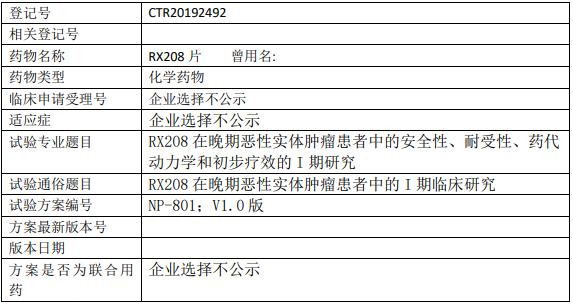
1、试验目的
主要目的: 考察 RX208 多次给药在人体内的安全性、耐受性,并确定最大耐受剂量(MTD)或最佳生物学剂量(OBD);
次要目的: 初步评价 RX208 多次给药的药代动力学特征; 初步评估 RX208 应用于 BRAF V600E 突变的晚期恶性实体肿瘤患者的抗肿瘤疗效。
2、试验设计
试验分类:安全性和有效性
试验分期:I期
设计类型:单臂试验
随机化:非随机化
盲法:开放
试验范围:国内试验
3、受试者信息
年龄:18 岁(最小年龄)至 NA 岁(最大年龄)
性别:男+女
健康受试者:无
入选标准
1.自愿入组并签署知情同意书,遵循试验治疗方案和访视计划;
2.组织学或细胞学确诊的晚期恶性实体肿瘤,经标准治疗失败,无标准治疗方案或现阶段不适用标准治疗;
3.肿瘤 BRAF V600E 突变检测为阳性;
4.根据 RECIST1.1 版实体肿瘤疗效评价标准,患者至少有一处影像学(CT、MRI)可测量病灶(剂量递增有可评估病灶即可),要求最长径10 mm(若为淋巴结,则要求短轴15 mm)(脑转移病灶不作为唯一可测量病灶)
5.预期生存期大于 3 个月;
6.ECOG 体力状态评分为 0 或 1;
7.患者在筛选时满足实验室检查要求;
8.有生育能力的合格患者(男性和女性)必须同意在试验期间和末次用药后至少 90 天内与其伴侣一起使用可靠的避孕方法
排除标准
1.过去 5 年内有其他恶性肿瘤病史的患者(不包括已经治愈的恶性肿瘤,如完全切除的基底细胞癌和原位癌)
2. 有严重的心脑血管病史
3. 首次使用研究药物前 4 周内接受过化疗、放疗、生物治疗、内分泌治疗、靶向治疗、免疫治疗等抗肿瘤治疗
4. 首次使用研究药物之前 4 周内接受过重大外科治疗、切开活检或明显创伤性损伤者
5. 无法口服吞咽药物,或存在经研究者判断严重影响胃肠道吸收的状况
6. 既往抗肿瘤治疗的不良反应尚未恢复到CTCAE 5.0等级评价1 级(脱发等研究者判断无安全风险的毒性除外)
7. 目前或曾患过间质性肺病
8. 妊娠期或哺乳期女性
9. 研究者认为受试者存在其他严重的系统性疾病史,或其他原因而不适合参加本临床研究
研究者信息
1、主要研究者信息
姓名:郭晔
学位:医学博士
职称:主任医师,教授
单位名称:上海市东方医院
2、各参加机构信息
机构名称:上海市东方医院
(主要)研究者:郭晔 教授
国家:中国
省(州)-城市:上海 -上海
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。