全球肿瘤医生网提醒患者:国内细胞免疫治疗技术,包括cart细胞,树突细胞疫苗,NK细胞,TILs细胞,TCR t细胞治疗,癌症疫苗等技术均处于临床试验阶段,未获准在医院正式使用。国内患者可以参加正规临床试验,在医生的监管下使用,全球肿瘤医生网不推荐患者贸然尝试任何医疗机构和研发机构的收费治疗。
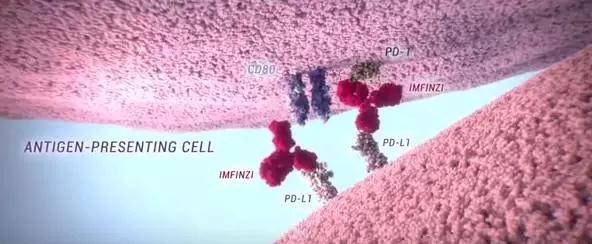
肿瘤免疫疗法领域在近期可谓是热度飙升。而阿斯利康(AstraZeneca)的首款免疫疗法药物Imfinzi(durvalumab)是一款有望为癌症患者带来希望的免疫疗法药物。作为一种人源化的抗PD-L1蛋白单克隆抗体,它能直接结合PD-L1蛋白,并抑制它与T细胞表面的PD-1蛋白和CD80的结合。肿瘤细胞就无法利用PD-L1/PD-1途径来逃避免疫系统的追杀。Durvalumab也正是利用这一机理,起到激活免疫系统,杀伤肿瘤的效果。先前,它曾获得了美国FDA颁发的与优先审评资格。全球肿瘤医生网整理了德瓦鲁单抗相关的药品信息,供患者参考。
Durvalumab(Imfinzi)
美国药品名称:Imfinzi
FDA批准Durvalumab(2017年5月1日)专门用于:
治疗局部晚期或转移性尿路上皮癌的患者,其:
1)在含铂化疗期间或之后具有疾病进展
2)在含铂化疗的新辅助治疗或辅助治疗的12个月内有疾病进展。
Imfinzi作为静脉给药的输液。推荐剂量为10mg / kg,每两周60分钟静脉滴注,直至疾病进展或不可接受的毒性。
临床数据及效果
FDA于2017年5月1日的加速批准是基于一项数据惊艳的编号为1108的研究,那么效果到底如何呢?我们详细看下:
尿路上皮癌I / II期试验1108研究
2017年5月1日,Imfinzi(一种阻断PD-L1的人单克隆抗体)获得FDA加速批准,基于来自研究1108的数据。该I / II期试验评估了Imfinzi在局部晚期或转移性尿路上皮癌患者中的安全性和有效性。在试验中,Imfinzi表现出快速和持久的反应,无论PD-L1状态如何,所有可评估患者的客观缓解率(ORR)分别为17.0%和26.3%,
该队列由182名局部晚期或转移性尿路上皮癌患者组成,其中铂类治疗或铂类治疗后进展,包括在接受新佐剂或佐剂治疗的12个月内进展的患者。这些患者在数据截止日期前至少13周开始了durvalumab治疗。所有患者均通过静脉滴注每2周接受Imfinzi 10 mg / kg长达12个月或直至不可接受的毒性或疾病进展。肿瘤评估在第6,12和16周进行,然后在第一年和第12周每8周进行一次。根据盲人独立中央评估(BICR)评估的RECIST v1.1和应答持续时间(DoR),确定了主要疗效结果指标的客观反应率(ORR)。ORR为17%,中位数DoR未达到。在31例患者中,1例(45%)持续6个月以上,6例(16%)持续反应12个月以上。
研究1(关于膀胱癌1108研究的数据)
所有患者
(N = 182)
PD-L1高
(N = 95)
PD-L1低/负(N = 73)
PD-L1无法评估(N = 14)
客观反应率(ORR)
31(17.0%)
25(26.3)
3(4.1%)
3(21.4%)
完全响应(CR)
5
3
1
1
部分响应(PR)
26
22
2
2
中位响应时间(DOR)
还未达到
还未达到
12.3
还未达到
除了尿路上皮癌,德瓦鲁单抗还在哪些癌症中表现突出,值得大家期待呢?
非小细胞肺癌III期PACIFIC试验
阿斯利康2017年7月31日发布的消息,美国食品药品监督管理局(FDA)已授予durvalumab (Imfinzi)用于治疗接受了标准含铂方案的同步放化疗后,未发生疾病进展的无法手术切除的局部晚期非小细胞肺癌(NSCLC)患者突破性疗法称号!此次突破性疗法是基于Imfinzi三期临床试验PACIFIC的中期结果,这是一个双盲,以安慰剂为对照组的多中心研究,研究目的为局部晚期不可手术的非小细胞肺癌患者(III期),在进行以铂类为基础的同步放化疗后,疾病无进展时以Durvalumab作为后续治疗药物的效果。
PACIFIC 是一项随机、双盲、安慰剂对照的国际多中心临床研究,Imfinzi (Durvalumab) 作为维持治疗,用于接受了标准的含铂方案同步放化疗后,未发生疾病进展的无法手术切除的局晚期(III期)非小细胞肺癌者。该试验在 26 个国家/地区的 235 个中心进行,入组约 700 多例患者。研究的主要终点为PFS和OS,次要终点包括 PFS 率与 OS率 、客观缓解率 (ORR) 及缓解持续时间等。
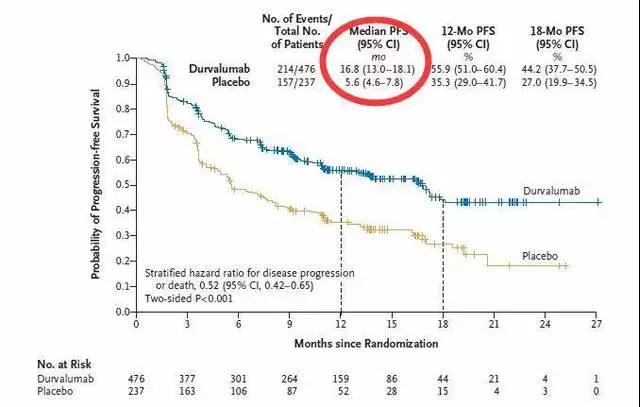
蓝色曲线为接受Durvalumab维持治疗患者的无进展生存期(PFS,即患者生存而肿瘤又没有长大的时间),橙色曲线为接受安慰剂患者。
结果显示:局部晚期患者接受标准的同步放化疗控制肿瘤后再接受Durvalumab维持治疗,肿瘤再次进展的时间达到16.8个月(接近1年半),使用安慰剂的情况只有不到半年(5.6个月)。
关键的是,不管PD-L1表达状态,EGFR是否突变,鳞癌还是腺癌,同步放化疗后肿瘤是缩小还是稳定,是否吸烟Durvalumab的疗效都比安慰剂好。
同时,durvalumab用于非小细胞肺癌辅助治疗的ADJUVANT三期临床试验正在进行中。在IV期的非小细胞肺癌患者的一线治疗中,durvalumab作为单药和与抗CTLA4药物tremelimumab联用的三期临床试验MYSTIC, NEPTUNE 和PEARL也正在进行中。POSEIDON是用于评估durvalumab单药联合化疗、durvalumab与tremelimumab联合化疗对比化疗的三期临床试验。让我们期待更多的临床数据尽快公布。
相关临床试验:01
Durvalumab + / Tremelimumab联合铂类化疗治疗未经治疗的广泛期小细胞肺癌( NCT03043872 )
这是一项III期随机,开放标签,多中心的全球性研究,旨在确定durvalumabtremelimumab联合铂类化疗(EP),durvalumabtremelimumab维持治疗与单用EP单药治疗的有效性和安全性。广泛期小细胞肺癌患者。
试验地点:
纽约
哥伦比亚大学/赫伯特欧文癌症中心
俄亥俄州
克利夫兰综合癌症中心
立即申请
想参加本临床试验的患者可关注全球肿瘤医生网微信公众号,根据提示提交病历资料,医学部会初步评估是否适合,并尽快与您联系,也可登录咨询详情。
Durvalmab作为治疗IIIB-IV期非小细胞肺癌患者的一线治疗( NCT02879617 )
该II期临床试验研究durvalumab的安全性以及作为一线治疗IIIB-IV期非小细胞肺癌患者的效果。durvalumab等药物的设计与免疫系统协同工作,有助于抗癌细胞抵抗肿瘤细胞发送的信号,阻止免疫系统良好运作。本研究中使用的durvalumab可以阻断这种信号,增加免疫反应,可以帮助人体建立有效的免疫应答来杀死肺癌细胞。
实验地点:
宾夕法尼亚
匹兹堡大学癌症研究所(UPCI)
立即申请
想参加本临床试验的患者可关注全球肿瘤医生网微信公众号,根据提示提交病历资料,医学部会初步评估是否适合,并尽快与您联系,也可登录咨询详情。
参考信息:
https://www.astrazeneca.com/media-centre/press-releases/2017/astrazenecas-imfinzi-durvalumab-receives-us-fda-accelerated-approval-for-previously-treated-patients-with-advanced-bladder-cancer-01052017.html
https://www.cancer.gov/news-events/cancer-currents-blog/2017/approvals-fda-checkpoint-bladder?cid=eb_govdel
https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm555930.htm
https://www.astrazeneca.com/media-centre/press-releases/2015/Durvalumab-ATLANTIC-trial-supports-clinical-activity-and-AstraZenecas-overall-immuno-oncology-strategy.html
本文由全球肿瘤医生网整理,转载请在文首注明来源。更多药品信息请登录或登录全球肿瘤医生网。
声明:
本公众号内容仅作交流参考,不作为诊断及医疗依据,仅依照本文而做出的行为造成的一切后果,由行为人自行承担责任。专业医学问题请咨询专业人士或专业医疗机构。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。
帮助广大患者在抗癌之路上少走/不走弯路
最终成功战胜病魔!
靶向治疗|最新资讯|临床试验|靶向药物|
基因检测|免疫治疗资讯|定期专家科普讲座