全球肿瘤医生网提醒患者:国内细胞免疫治疗技术,包括cart细胞,树突细胞疫苗,NK细胞,TILs细胞,TCR t细胞治疗,癌症疫苗等技术均处于临床试验阶段,未获准在医院正式使用。国内患者可以参加正规临床试验,在医生的监管下使用,全球肿瘤医生网不推荐患者贸然尝试任何医疗机构和研发机构的收费治疗。
好莱坞女星安吉丽娜朱莉披露,她由于携带乳腺癌1号基因(BRCA1),已经接受预防性的双侧乳腺切除手术,以降低罹癌风险。
上周五,FDA批准了Lynparza治疗携带BRCA突变基因、且接受过化疗的遗传性乳腺癌患者!值得一的是,这是FDA批的首个治疗遗传性乳腺癌创新药,用于治疗遗传基因缺陷引起的乳腺癌(晚期)!
遗传性乳腺癌的现状:
根据美国国家癌症研究中心统计,每年大约有25万人确诊患有乳腺癌,其中4万人死于乳腺癌。大约2025%的患者携带遗传性乳腺癌BRCA突变基因,而且携带突变基因的患者多为年轻人。与其他类型乳腺癌相比,携带遗传性乳腺癌突变基因的患者临床治疗效果和预后不佳。
首个治疗遗传性乳腺癌的新药-奥拉帕尼
作为一款PARP(多聚ADP-核糖聚合酶)抑制剂,Lynparza可以进一步阻断参与修复受损DNA的PARP酶,使具有受损BRCA基因的癌细胞内的DNA突变积重难返,从而导致细胞死亡,减缓或阻止肿瘤生长。
美国药品名称:Lynparza
厂商:阿斯利康
FDA批准的临床适应症有哪些?
FDA批准奥拉帕尼(Olaparib)
2018年1月12日:
用于治疗携带BRCA突变的HER2-转移性乳腺癌。
2017年8月17日:
用于上皮卵巢癌、输卵管癌、原发腹膜癌应用铂类为基础化疗后,疗效评价为CR或PR患者的维持治疗。
2014年:
用于治疗晚期卵巢癌。它被用于那些癌症在BRCA1或BRCA2基因中有一定突变的患者,并且已经接受了至少三种其他类型的化疗。
主要试验数据:
1.OlympiAD(NCT02000622)
实验设计
招募了302名遗传性乳腺癌晚期患者,这些转移性乳腺癌患者同时被明确携带有BRCA基因突变。
临床数据
Lynparza组患者的中位PFS为7个月,而化疗组患者的中位PFS为4.2个月,疾病进展或死亡风险降低了42%。Lynparza组患者的客观缓解率为52%,相当于化疗组患者的两倍(23%)。此外,Lynparza组患者的完全缓解率为7.8%,化疗组为1.5%。
Lynparza治疗后产生的副作用并没有联合化疗更严重,但也会出现诸如血液和骨肿瘤等伴随的严重副作用。其它常见副作用包括恶心、疲劳、呼吸道感染和血象改变等问题。
2.SOLO-2 (NCT01874353)
实验设计
研究入组了295例BRCA突变的卵巢、输卵管或原发腹膜癌患者,随机分配至治疗组和安慰剂组(2:1)进行维持治疗。治疗组患者接受奥拉帕尼片 300mg 口服治疗,每天两次,安慰剂组接受等量的安慰剂。
临床数据
治疗组研究者评估的无进展生存(PFS) 比安慰剂组高出2倍以上,中位PFS分别为19.1个月和5.5个月(HR, 0.30; 95%CI, 0.22-0.41; P<0.0001)。
独立机构评审的PFS两组差异更大,中位PFS分别为30.2个月和5.5个月(HR, 0.25; 95%CI, 0.18-0.35; P<0.0001)。所以,奥拉帕尼可以减少70%-75%的疾病复发风险。该研究作者表示,SOLO-2研究数据显示了奥拉帕尼有意义的改善了BRAC突变患者的临床结局。
3. STUDY 19 -(NCT00753545)
实验设计
研究纳入了265名患者,随机分配至治疗组和安慰剂组。该研究与SOLO-2研究的区别是该研究也纳入了患者没有BRCA突变的患者。治疗组接受400mg(口服,每天两次)奥拉帕尼胶囊治疗,安慰剂组接受等量的安慰剂治疗。
临床数据
结果表明,治疗组与安慰剂组研究者评估的中位PFS分别为8.4个月和4.8个月,统计学有显著差异(HR, 0.35; 95%CI, 0.25-0.49; p<0.0001)。
BRCA突变患者亚组中,治疗组的中位PFS为11.2个月,安慰剂组为4.3个月(HR, 0.18, p<0.0001)在19研究的中期分析中,治疗组的中位OS为29.8个月,安慰剂组为27.8个月(HR, 0.73; 95%CI, 0.55-0.96; P=0.02483)。
BRCA突变的亚组中,两组的OS分别为34.9个月 vs 30.2个月(HR, 0.62; 95%CI, 0.41-0.94; P=0.02480)。
但是,这两个OS的结果没有达到预设的统计学意义标准。
Lynparza的价格及国内上市时间
根据阿斯利康公布的信息,在无医保情况下,Lynparza的药费将高达1.39万美元/每月(约合人民币9万/每月)。阿斯利康正在考虑为患者提供一定经济救助。迄今为止,还没有用于治疗转移性乳腺癌(晚期)的有效药。Lynparza获批,是因为它可以延缓疾病进程,给晚期乳腺癌患者带来新希望!
FDA在声明中强调,这是治疗遗传因素诱发癌症的全新尝试。同时,FDA还批准了Myriad Genetic Laboratories检测BRCA基因突变的试剂,以便精准确定哪些患者在接受Lynparza治疗时可能获益。
目前国内尚未有类似或同类药上市!
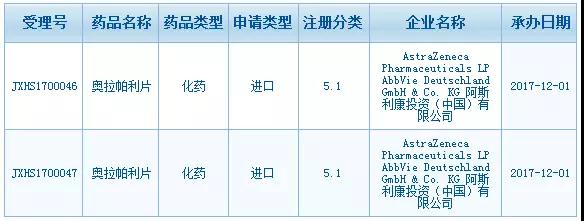
2017年12月1日,Olaparib在中国递交的上市申请正式获得CDE承办受理,距离其首次获得FDA批准上市刚好过去3年的时间。
用药指导
口服,每天两次(间隔12小时),整片吞服,不要嚼碎、溶解;
胶囊型与片剂型药物含量不同,不要混服;
不要食用含有葡萄柚及橙子成分的食物;
漏服之后不要补服,正常下次剂量即可;
盖好盖子,常温保存,远离儿童。
常见副作用
恶心、呕吐、腹泻、便秘、胃灼热、头痛、食欲下降、肌肉关节痛或背部疼痛、疲劳、
腹部疼痛或不适、味觉变化、口腔疼痛或溃疡、焦虑、抑郁症、皮肤干燥、瘙痒、皮疹、
难以入睡或无法入睡、喉咙痛、流鼻涕或其他感冒症状、小便疼痛
严重副作用(必要时尽快就医)
发烧、咳嗽、喘息;呼吸急促;虚弱;极度疲劳;体重下降;手或脚的麻木、刺痛或灼烧感;
瘀伤或出血;皮肤苍白;尿血或便血
参考资料:
[1]https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm592357.htm
[2]http://www.onclive.com/web-exclusives/fda-approves-olaparib-for-brca-breast-cancer
声明:
本公众号内容仅作交流参考,不作为诊断及医疗依据,仅依照本文而做出的行为造成的一切后果,由行为人自行承担责任。专业医学问题请咨询专业人士或专业医疗机构。
本网站新闻资讯、文章、研究数据、治疗案例均来自于国内外医学论文,所涉及到的新药、新技术有可能还处于临床研究阶段,患者不能作为治疗疾病的依据。癌症治疗目前尚无治愈手段,患者需要在医生的指导下,在医院接受正规治疗或参加新药新技术临床试验。
帮助广大患者在抗癌之路上少走/不走弯路
最终成功战胜病魔!
靶向治疗|最新资讯|临床试验|靶向药物|
基因检测|免疫治疗资讯|定期专家科普讲座